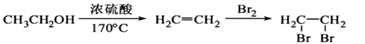在一定体积的密闭容器中进行某化学反应,其平衡常数表达式为K= 。
。
化学平衡常数K和温度t的关系如下表:
| t℃ |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应的化学方程式为 。
(2)该反应为 反应(填“吸热”或“放热”)。
(3)能判断该反应是否达到化学平衡状态的依据是 (多选扣分)。
A.容器中压强不变 B.混合气体中 c(CO)不变
C.υ正(H2)=υ逆(H2O) D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为
℃。
(5)某温度下,将CO和水蒸气各1mol置于体积为1L的密闭容器中反应,达到平衡后测得CO2为0.5mol,再通入4mol水蒸气,达到新的平衡后CO2的物质的量等于__________mol。
硫及其化合物和氮及其化合物在化学工业、环境保护中应用非常广泛。
(1)汽车尾气中主要含有CO、NO2、SO2、CO2气体,其中 能导致酸雨的形成,收集SO2形成的酸雨,pH逐渐减小,一定时间后pH不再变化,写出酸雨中反应的离子方程式 。
(2)用CH4催化还原NOx可以消除氮氧化物的污染。己知:
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l) ΔH=-955 kJ·mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(l)ΔH=-890.3l kJ·mol-1
2NO(g)+O2(g)=2NO2(g)ΔH=-112.97 kJ·mol-1
写出CH4(g)催化还原NO(g)生成N2(g)、CO2(g)和H2O(l)的热化学方程式: 。
(3)工业上生产硫酸时,将SO2氧化为SO3是关键一步。
①某温度下,已知2SO2(g)+O2(g) 2SO3(g),△H=" —196" kJ· mol—1。开始时在10L的密闭容器中加入4.0mol SO2(g)和5.0mol O2(g),5分钟后反应达到平衡,共放出热量196kJ,该温度下此反应的平衡常数K= ,用SO2表示的反应速率为 。
2SO3(g),△H=" —196" kJ· mol—1。开始时在10L的密闭容器中加入4.0mol SO2(g)和5.0mol O2(g),5分钟后反应达到平衡,共放出热量196kJ,该温度下此反应的平衡常数K= ,用SO2表示的反应速率为 。
②一定条件下,向一带活塞的密闭容器中充入2 mol SO2和1molO2,发生下列反应:2SO2(g)+O2(g) 2SO3(g),达到平衡后改变下述条件,SO2、O2、SO3气体平衡浓度都比原来增大的是 (填字母)。
2SO3(g),达到平衡后改变下述条件,SO2、O2、SO3气体平衡浓度都比原来增大的是 (填字母)。
| A.保持温度和容器内压强不变,充入1mol Ar |
| B.保持温度和容器体积不变,充入2 mol N2 |
| C.保持温度和容器体积不变,充入2 mol SO3 |
| D.升高温度 |
E.移动活塞压缩气体
(4)某人设想以右图所示装置,用电化学原理生产硫酸,通入O2的电极为 极,写出通入SO2的电极的电极反应式 。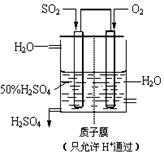
[物质结构与性质]
铜、碳、氮、氧、硫、氯等是组成物质的重要元素。
(1)根据等电子体原理,羰基硫(OCS)分子的结构式应为 。光气(COC12)分子内各原子最外层都满足8电子稳定结构,则光气分子的空间构型为 (用文字描述)。
(2)铜离子是人体内多种酶的辅因子,人工模拟酶是当前研究的热点。某化合物Y 与Cu(Ⅰ)(Ⅰ表示化合价为+1)结合形成图所示的离子:
①写出Cu(Ⅰ)的电子排布式 ;
②该离子中含有化学键的类型有 (选填序号);
| A.非极性键 | B.离子键 | C.配位键 | D.极性键 |
③该离子中C原子的杂化方式有 。
(3)向氯化铜溶液中通入足量的二氧化硫,生成白色沉淀M,M的结构如图所示。写出M的化学式 。
污染与环境保护已经成为现在我国最热门的一个课题,污染分为空气污染,水污染,土壤污染等。

(1)为了减少空气中SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。
已知:H2(g)+ O2(g)===H2O(g)ΔH1=-241.8 kJ·mol-1
O2(g)===H2O(g)ΔH1=-241.8 kJ·mol-1
C(s)+ O2(g)===CO(g)ΔH2=-110.5 kJ·mol-1
O2(g)===CO(g)ΔH2=-110.5 kJ·mol-1
C(s)+H2O(g) = CO(g) +H2(g)ΔH= 。
该反应的平衡常数表达式为K= 。
②洗涤含SO2的烟气。以下物质可作洗涤剂的是 (选填序号)。
a.CaCl2 b.氨水 c.Na2CO3 d.NaHSO3
(2)为了减少空气中的CO2,目前捕碳技术在降低温室气体排放中具有重要的作用,捕碳剂常用(NH4)2CO3,反应为:(NH4)2CO3(aq)+H2O(l)+CO2(g)=2NH4HCO3(aq) ΔH3
为研究温度对(NH4)2CO3捕获CO2效率的影响,在某温度T1下,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体(用氮气作为稀释剂),在t时刻,测得容器中CO2气体的浓度。然后分别在温度为T2、T3、T4、T5下,保持其他初始实验条件不变,重复上述实验,
经过相同时间测得CO2气体浓度,其关系如图,则: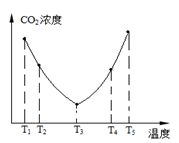
①T2、T4温度下,该反应的反应速率v2 v4(填“>”、“=”或“<”)。
②在T3~T4这个温度区间,容器内CO2气体浓度变化趋势的原因是: 。
(3)催化反硝化法降解法可用于治理水中硝酸盐的污染。
①催化反硝化法中,用H2将NO还原为N2,一段时间后,
溶液的碱性明显增强。则反应离子方程式为: 。
②Murphy等人利用粉末铝去除废水总硝酸盐,反应主要产物为氨,占60~95%,可以通过气提法除去。反应方程式为:
3NO3- + 2Al + 3H2O → 3NO2- + 2Al(OH)3
NO2- + 2Al + 5H2O → NH3 + 2Al(OH)3 + OH-
2NO2- + 2Al + 4H2O → N2 + 2Al(OH)3 + 2OH-
若足量的铝与硝酸盐反应产生224mL(标准状况)混合气体,其中氨占80%,则被NO3-氧化的铝的物质的量为 。
从含镁、钾盐湖水中蒸发最后得到的产物中含光卤石(xKCl·yMgCl2·zH2O),它在空气中极易潮解、易溶于水,是制造钾肥和提取金属镁的重要原料,其组成可通过下列实验测定: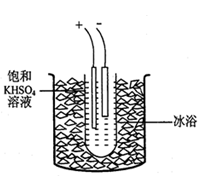
①准确称取11.100g样品溶于水,配成l00.00mL溶液。
②取25.00mL溶液,加入NaOH溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体0. 580g。
③另取25.00mL溶液,加入足量的硝酸酸化的AgNO3溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体4.305g。
(1)步骤②中检验沉淀完全的方法是 。
(2)若步骤③中为了加快干燥速度,置于阳光直射下干燥沉淀,结果出现沉淀变黑。测得光卤石结晶水含量将 (填“偏高”、或“偏低”或“不变”)。
(3)通过计算确定样品的组成(写出计算过程)。
氧氮杂是新药研制过程中发现的一类重要活性物质,具有抗惊厥、抗肿瘤、改善脑缺血等性质。下面是某研究小组提出的一种氧氮杂化合物H的合成路线: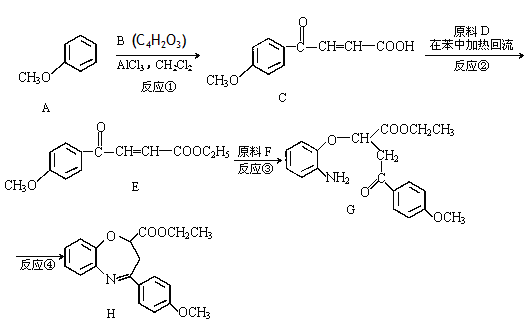
完成下列填空:
(1)写出五元环B的结构简式: 。
(2)有机物E中含有的含氧官能团名称是________、__________和酯基;反应③的反应类型是_____________。
(3)写出符合下列条件的C的一种同分异构体的结构简式: 。
①能发生水解反应且产物之一能发生银镜反应;
②与氯化铁溶液发生显色反应;
③含有四种不同化学环境的氢;
④只含有一个环,且苯环无氢原子。
(4)写出反应②的化学方程式
______________________________________________。
(5)已知:①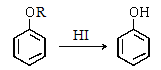 (R为烃基)
(R为烃基)
②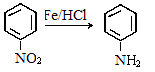
③酚具有还原性,能被氧化剂氧化。
写出以A和丙烯醛(CH2=CHCHO)为原料制备的合成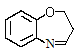 路线流程图(无机试剂任用)。合成路线流程图示例如下:
路线流程图(无机试剂任用)。合成路线流程图示例如下: