氧氮杂是新药研制过程中发现的一类重要活性物质,具有抗惊厥、抗肿瘤、改善脑缺血等性质。下面是某研究小组提出的一种氧氮杂化合物H的合成路线:
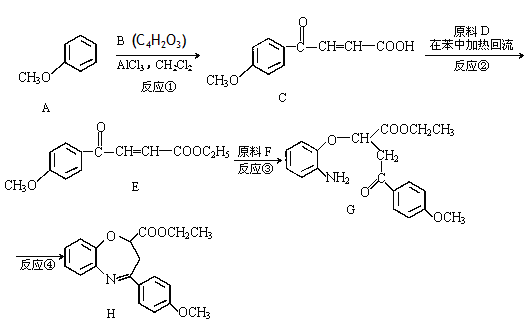
完成下列填空:
(1)写出五元环B的结构简式: 。
(2)有机物E中含有的含氧官能团名称是________、__________和酯基;反应③的反应类型是_____________。
(3)写出符合下列条件的C的一种同分异构体的结构简式: 。
①能发生水解反应且产物之一能发生银镜反应;
②与氯化铁溶液发生显色反应;
③含有四种不同化学环境的氢;
④只含有一个环,且苯环无氢原子。
(4)写出反应②的化学方程式
______________________________________________。
(5)已知:①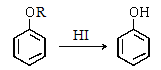 (R为烃基)
(R为烃基)
②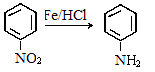
③酚具有还原性,能被氧化剂氧化。
写出以A和丙烯醛(CH2=CHCHO)为原料制备的合成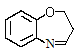 路线流程图(无机试剂任用)。合成路线流程图示例如下:
路线流程图(无机试剂任用)。合成路线流程图示例如下: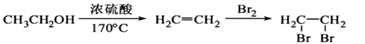
据报道,一辆盛浓硫酸的槽车,开至某转弯处,由于车速太快,车体倾翻,大量浓硫酸洒满路面.为了减少损害,现有如下方法:①立即调用大量的水冲洗地面;②立即从路基旁边取土将浓硫酸覆盖;③立即调用大量石灰乳覆盖.
你赞成的方法是_____________,不赞成的方法是_____________,理由是_________________。
(1)氢氧化钠俗称苛性钠,其固体必须密封保存,这是因为它不仅能吸收空气里的_______________,而且能跟空气里的__________________反应.
(2)稀释浓硫酸时,一定要把____________沿着器壁慢慢地注入__________________中,并不断搅拌.
要把鸡蛋保存相当长的一段时间,有人提出了四种方法:①放入冰箱中;②放入食盐水中;③放入石灰水中;④煮熟了保存.
你认为最好的方法是______(填序号),你的理由是___________________________________.
现有盐酸、熟石灰、烧碱、食盐四种物质,其中能用于金属除锈的是__________________,能用于改良酸性土壤的是__________________.
对溶解度受______________变化影响不大的固体物质一般用______________方法得到固体溶质,例如从海水中提取______________;对溶解度受______________变化影响相当大的固体溶质一般用______________的方法得到固体.