某有机化合物A因其具有麻醉作用,常用作局部麻醉剂和镇痛剂。它的结构简式如图所示,请回答: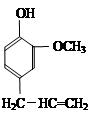
(1) A的分子式是 。
(2) 有机物A不能发生的化学反应有(填序号) 。
a.加成反应 b.水解反应[
c.加聚反应 d.氧化反应
(3)满足下列条件的A的同分异构体有 种,写出其中一种的结构简式 。
①能与碳酸氢钠溶液反应;
②核磁共振氢谱显示有四种类型氢原子的吸收峰
不能说明氧元素比硫元素非金属性强的事实是
| A.热稳定性H2O比H2S强 |
| B.H2S水溶液在空气中变浑浊 |
| C.H2O比H2S的沸点高 |
| D.在一定条件下,O2与Cu反应生成CuO,S与Cu反应生成Cu2S |
元素性质呈周期性变化的根本原因是
| A.核外电子排布呈周期性变化 | B.元素的相对原子质量逐渐增大 |
| C.核电荷数逐渐增大 | D.元素化合价呈周期性变化 |
在某无色溶液中,加入盐酸酸化的BaCl2溶液有白色沉淀,则下列判断正确的是
| A.一定有SO42- | B.可能有SO42-或Ag+ |
| C.一定有Ag+ | D.可能有SO32-或SO42- |
下列各组气体中,在通常状况下能共存,并且都能用浓硫酸干燥的是
| A.SO2、H2S、Cl2 | B.SO2、O2、NH3 |
| C.SO2、CO2、O2 | D.HCl、H2S、HI |
检验试管中盛有的少量白色固体是铵盐的方法是
| A.将固体加热,用湿润的红色石蕊试纸在试管口检验,看是否变蓝 |
| B.加水溶解,用pH试纸测溶液的酸碱性 |
| C.加入NaOH溶液,加热,再滴入酚酞试液 |
| D.加入NaOH溶液,加热,用湿润的红色石蕊试纸在试管口检验,看是否变蓝 |