近年来北京市汽车拥有量呈较快增长趋势,汽车尾气已成为重要的空气污染物。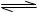 (1)汽车内燃机工作时引起反应:N2(g)+O2(g) 2NO(g),是导致汽车尾气中含有NO的原因之一。T℃时,向容积为2 L的密闭容器中充入10molN2与5molO2,达到平衡后NO的物质的量为2mol,则T℃时该反应的平衡常数K= 。(计算结果保留小数点后两位数字)
(1)汽车内燃机工作时引起反应:N2(g)+O2(g) 2NO(g),是导致汽车尾气中含有NO的原因之一。T℃时,向容积为2 L的密闭容器中充入10molN2与5molO2,达到平衡后NO的物质的量为2mol,则T℃时该反应的平衡常数K= 。(计算结果保留小数点后两位数字)
(2)一定量的NO发生分解的过程中,NO的转化率随时间变化的曲线如图所示。(已知: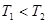 )
)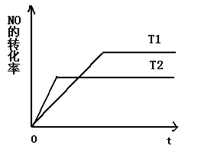
 ①反应2NO(g) N2(g)+O2(g)为(填“吸热”或“放热) 反应。
①反应2NO(g) N2(g)+O2(g)为(填“吸热”或“放热) 反应。 ②一定温度下,能够说明反应2NO(g) N2(g)+O2(g)已达到平衡的是(填序号) 。
②一定温度下,能够说明反应2NO(g) N2(g)+O2(g)已达到平衡的是(填序号) 。
a.容器内的压强不发生变化
b.NO、N2、O2的浓度保持不变
c.NO分解的速率和NO生成的速率相等
d.单位时间内分解4mol NO,同时生成2 mol N2
(3)①当发动机采用稀薄燃烧时,尾气中的主要污染物为NOx,可用CxHy(烃)催化还原NO2消除氮氧化物的污染。
已知:CH4(g)+4NO2(g) 4NO(g)+CO2(g)+2H2O(g) △H1=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)=CO2(g)+2H2O(g) △H2
CH4(g)+2NO2(g)N2(g)+CO2(g)+2H2O(g) △H3=-867kJ·mol-1
△H2= .
②使用催化剂可以将汽车尾气的主要有害成分一氧化碳(CO)和氮氧化物(NOx)转化为无毒气体,该反应的化学方程式为 。
(共10分)某无色溶液,其中可能存在Na+、Ba2+、AlO2-、S2-、SO32-、SO42-。取该溶液进行有关实验,实验结果如下图所示。
请回答下列问题:
(1)沉淀甲的化学式为;
(2)由溶液甲生成沉淀乙的离子方程式为_______________;
(3)沉淀丙中一定含有(填化学式,下同),可能含有;
(4)综合上述信息,该溶液中肯定存在的离子有___________________。
(共14分) 2SO2(g)+O 2(g) =2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3的ΔH=-99kJ·mol-1.请回答下列问题:
2(g) =2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3的ΔH=-99kJ·mol-1.请回答下列问题:
(1)图中A、C分别表示、,E的大小对该反应的反应热有无影响?(填“有影响”或“无影响”)。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?,理由是;
(2)图中△H=KJ·mol-1;
(3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化 学方程式;
学方程式;
(4)如果反应速率υ(SO2)为0.05 mol·L-1·min-1,则υ(O2)= mol·L-1·min-1、υ(SO3)=mol·L-1·min-1;
(5)已知单质硫的燃烧热为296 KJ·mol-1,计算由S(s)生成3 molSO3(g)的△H(要求计算过程)。
(共6分)瑞典皇家 科学院宣布,将2007年诺贝尔化学奖授予德国马普学会弗里茨-哈伯(Fritz-Haber)研究所的格哈德·埃特尔(Gerhard Ertl)教授,以表彰他在固体表面化学过程研究领域作出的开拓性成就。合成氨工业生产中所用的α-Fe催化剂的主要成分是FeO、Fe2O3。
科学院宣布,将2007年诺贝尔化学奖授予德国马普学会弗里茨-哈伯(Fritz-Haber)研究所的格哈德·埃特尔(Gerhard Ertl)教授,以表彰他在固体表面化学过程研究领域作出的开拓性成就。合成氨工业生产中所用的α-Fe催化剂的主要成分是FeO、Fe2O3。
(1)某FeO、Fe2O3混合物中,铁、氧的物质的量之比为4:5,其中Fe2+与Fe3+物质的量之比为_________。
(2)当催化剂中Fe2+与Fe3+物质的量之比为1:2时,其催化活性最高,此时铁的氧化物混合物中铁的质量分数为_________(用小数表示)。
(3)以Fe2O3为原料制备上述催化剂,可向其中加入适量碳粉,发生如下反应:
2Fe2O3 +C  =4FeO +CO2↑,为制得这种催化活性最高的催化剂,应向480g Fe2O3粉末中加入碳粉的质量为_________ g。
=4FeO +CO2↑,为制得这种催化活性最高的催化剂,应向480g Fe2O3粉末中加入碳粉的质量为_________ g。
从某些植物树叶提取的挥发油中含有下列主要成分:
(1)有关A、B、C三种物质的说法正确的是(填序号)
a.均能发生加聚反应 b.只有B能与FeCl3发生显色反应
c.均不能与氢氧钠溶液反应 d.只有C能发生银镜反应
(2)A中苯环上的一卤代物的同分异构体的数目为。
(3)0.5molB与足量的溴水充分反应,消耗mol单质溴。
(4)写出A与B在一定条件下相互反应,生成高分子化合物的化学方程式:
(5)已知:

有机物C9H8O发生如下反应:
则C9H8O的结构简式为。

 (1)合成氨反应反应N2(g)+3H2(g)
(1)合成氨反应反应N2(g)+3H2(g) 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡移动(填“向左”“向右”或“不”);使用催化剂反应的ΔH(填“增大”“减小”或“不改变”)。
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡移动(填“向左”“向右”或“不”);使用催化剂反应的ΔH(填“增大”“减小”或“不改变”)。 (2)已知:N2H4(g)+O2(g)=N2(g)+2H2O(g);△H=-543kJ·mol-1
(2)已知:N2H4(g)+O2(g)=N2(g)+2H2O(g);△H=-543kJ·mol-1
 H2(g)+
H2(g)+ F2(g)=HF(g);△H=-269kJ·mol-1
F2(g)=HF(g);△H=-269kJ·mol-1
H2(g)+ O2(g)=H2O(g);△H=-242kJ·mol-1
O2(g)=H2O(g);△H=-242kJ·mol-1 则反应 N2H4(g)+2F2(g)=N2(g)+4HF(g)的
则反应 N2H4(g)+2F2(g)=N2(g)+4HF(g)的 H="_____________" kJ·mol-1。
H="_____________" kJ·mol-1。 (3)已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.2×10-20。在25℃下,向浓度均为0.1 mol·L-1的MgCL2和CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式为______。
(3)已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.2×10-20。在25℃下,向浓度均为0.1 mol·L-1的MgCL2和CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式为______。 (4)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),则溶液显_____________性(填“酸”“碱”或“中”);用含a的代数式表示此时溶液中NH3·H2O的物质的量浓度__________ mol·L-1。(说明:溶液的体积可以直接相加)
(4)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),则溶液显_____________性(填“酸”“碱”或“中”);用含a的代数式表示此时溶液中NH3·H2O的物质的量浓度__________ mol·L-1。(说明:溶液的体积可以直接相加)