如图所示一套实验装置来制取乙酸乙酯
A中盛有乙醇、浓硫酸和醋酸的混合液,C中盛有饱和碳酸钠溶液。
已知:①氯化钙可与乙醇形成难溶于水的CaCl2·6C2H5OH,②有关有机物的沸点:
| 试剂 |
乙醚 |
乙醇 |
乙酸 |
乙酸乙酯 |
| 沸点(℃) |
34.7 |
78.5 |
117.9 |
77.1 |
(1)浓硫酸的作用是 ;
(2)若实验中用含18O的乙醇与乙酸作用,则表示该反应原理的化学方程式是 ;
(3)球形管B除起冷凝作用外,另一重要作用是 ;
(4)反应中所用的乙醇是过量的,其目的是 ;
(5)从C中分离出乙酸乙酯必须使用的一种仪器是______;分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入饱和氯化钙溶液分离出__________,再加入无水硫酸钠,然后进行蒸馏,收集77℃的馏分,以得到较纯净的乙酸乙酯。
含硫物质燃烧会产生大量烟气,主要成分是SO2、CO2、N2、O2 。某研究性学习小组在实验室利用下列装置制备模拟烟气,并测算模拟烟气通过转化器的脱硫效率。
回答下列问题:
Ⅰ.模拟烟气的制备
(1)用A装置制SO2,化学反应方程式为。
(2)用B装置制CO2,使用该装置优点的是。
(3)将制得的气体与空气充分混合,获得模拟烟气用于后续实验。
II.测定烟气中SO2的体积分数
(4)将部分模拟烟气缓慢通过C、D装置,其中C、D中盛有的药品分别是、。(填序号)
①KMnO4溶液;②饱和NaHSO3溶液;③饱和Na2CO3溶液;④饱和NaHCO3溶液
(5)若模拟烟气的流速为amL/min,若t1分钟后,测得量筒内液体体积为VmL,则SO2的体积分数是。
Ⅲ.测算模拟烟气通过转化器的脱硫效率(已转化的SO2占原有SO2的百分比)
(6)将模拟烟气通过转化器E装置,E装置中盛有FeCl2、FeCl3的混合溶液,常温下,它可催化SO2与O2的反应,以达到脱硫目的。写出催化剂参与反应过程的离子方程式 ①SO2+2H2O+2Fe3+=SO42-+2Fe2++4H+②。
(7)若模拟烟气仍以amL/min的流速通过转化器E装置,t2分钟后,向E装置中加入酸化的BaCl2溶液得到白色浑浊液,经、洗涤、、称量,得到mg固体。若实验的气体体积已折算为标准状况,则该转化器的脱硫效率是。
氯离子插层镁铝水滑石 是一种新型离子交换材料,其在高温下完全分解为
是一种新型离子交换材料,其在高温下完全分解为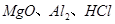 和水蒸气,现用题27图装置进行试验确定其化学式(固定装置略去)。
和水蒸气,现用题27图装置进行试验确定其化学式(固定装置略去)。
(1) 热分解的化学方程式为。
热分解的化学方程式为。
(2)若只通过测定装置C、D的增重来确定 ,则装置的连接顺序为(按气流方向,用接口字母表示),其中C的作用是。装置连接后,首先要进行的操作名称是。
,则装置的连接顺序为(按气流方向,用接口字母表示),其中C的作用是。装置连接后,首先要进行的操作名称是。
(3)加热前先通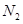 排尽装置中的空气,称取C、D的初始质量后,再持续通入
排尽装置中的空气,称取C、D的初始质量后,再持续通入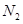 的作用是、等.
的作用是、等.
(4)完全分解后测得C增重3.65g、D增重9.90g,则 =.若取消冷却玻管B后进行试验,测定
=.若取消冷却玻管B后进行试验,测定 值将(填“偏高”或“偏低”)
值将(填“偏高”或“偏低”)
(5)上述水滑石在空气中放置时易发生反应生成[Mg2Al(OH)6Cl1—2y(CO3)y·zH2O],该生成物能发生类似的热分解反应,现以此物为样品,用(2)中连接的装置和试剂进行实验测定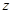 ,除测定D的增重外,至少还需测定 .
,除测定D的增重外,至少还需测定 .
现拟用下图所示装置(尾气处理部分略)来制取一氧化碳,并用以测定某铜粉样品(混有CuO粉末)中金属铜的含量。
(1)制备一氧化碳的化学方程式是;
(2)试验中,观察到反应管中发生的现象时;
尾气的主要成分是;
(3)反应完成后,正确的操作顺序为(填字母)
a.关闭漏斗开关 b.熄灭酒精1 c.熄灭酒精灯2
(4)若试验中称取铜粉样品5.0g,充分反应后,反应管中剩余固体的质量为4.8g,则原样品中单质铜的质量分数为;
(5)从浓硫酸、浓硝酸、蒸馏水、双氧水中选用合适的试剂,设计一个测定样品中金属铜质量分数的方案;
①设计方案的主要步骤是(不必描述操作过程的细节);
②写出有关反应的化学方程式。
甲、乙两个研究性学习小组为测定氨分子中氮、氢原子个数比,设计如下实验流程:
实验中,先用制的的氨气排尽洗气瓶前所有装置中的空气,再连接洗气瓶和气体收集装置,立即加热氧化铜。反应完毕后,黑色的氧化铜转化为红色的铜。
下图A、B、C为甲、乙两小组制取氨气时可能用到的装置,D为盛有浓硫酸的洗气瓶。
甲小组测得,反应前氧化铜的质量m1g、氧化铜反应后剩余固体的质量m2g、生成氮气在标准状况下的体积V1L。
乙小组测得,洗气前装置D的质量m3g、洗气后装置D的质量m4g、生成氨气在标准状况下的体积V2L。
请回答下列问题:
(1)写出仪器a的名称。
(2)检查A装置气密性的操作是。
(3)甲、乙两小组选择了不同的方法制取氨气,请将实验装置的字母编号和制备原理填写在下表的空格中。
| 实验装置 |
实验药品 |
制备原理 |
|
| 甲小组 |
A |
氢氧化钙、硫酸、硫酸铵 |
反应的化学方程式为 ①。 |
| 乙小组 |
② |
浓氨水、氢氧化钠 |
用化学平衡原理分析氢氧化钠的作用: ③。 |
(4)甲小组用所测得数据计算出氨分子中氮、氢的原子个数之比为。
(5)乙小组用所测得数据计算出氨分子中氮、氢的原子个数比明显小于理论值,其原因是。为此,乙小组在原有实验的基础上增加了一个装有某药品的实验仪器,重新实验。根据实验前后该药品的质量变化及生成氨气的体积,得出了合理的实验结果。该药品的名称是。
实验室常用MnO2与浓盐酸反应制备Cl2(发生装置如右图所示)。
(1)制备实验开始时,先检查装置气密性,接下来的操作依次是_(填序号)
A.往烧瓶中加人MnO2粉末
B.加热
C.往烧瓶中加人浓盐酸
(2)制备反应会因盐酸浓度下降而停止。为测定反应残余液中盐酸的浓度,探究小组同学提出下列实验方案:
甲方案:与足量AgNO3溶液反应,称量生成的AgCl质量。
乙方案:采用酸碱中和滴定法测定。
丙方案:与已知量CaCO3(过量)反应,称量剩余的CaCO3质量。
丁方案:与足量Zn 反应,测量生成的H2体积。
继而进行下列判断和实验:
① 判定甲方案不可行,理由是。
② 进行乙方案实验:准确量取残余清液稀释一定倍数后作为试样。
a.量取试样20.00 mL,用0 . 1000 mol·L-1 NaOH标准溶液滴定,消耗22.00mL,该次滴定测得试样中盐酸浓度为mol·L-1
b.平行滴定后获得实验结果。
③ 判断丙方案的实验结果(填“偏大”、“偏小”或“准确”)。
[已知:Ksp(CaCO3 ) = 2.8×10-9、Ksp(MnCO3 ) = 2.3×10-11
④ 进行丁方案实验:装置如右图所示(夹持器具已略去)。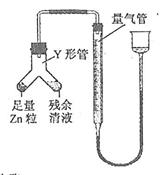
(i) 使Y形管中的残余清液与锌粒反应的正确操作是将转移到中。
(ii)反应完毕,每间隔1 分钟读取气体体积,气体体积逐次减小,直至不变。气体体积逐次减小的原因是(排除仪器和实验操作的影响因素)。