下图是实验室常用的实验仪器及实验装置图,请据图回答:
(1)写出上图中序号①~④仪器的名称:② ; ③ ;④ ;
(2)仪器①~④中,使用时必须检查是否漏水的有 ;(填仪器序号)
(3)若向II装置中加入碘水和少量CCl4,振荡后静置,会观察到什么现象? ;静置后,再将液体分离的操作是_______________________________;
(4)装置I中冷凝水由 (填a或b)口通入,温度计水银球的位置是 ;
(5)选择下列实验方法分离物质,将分离方法的序号填在横线上。
| A.萃取分液法 | B.加热分解 | C.结晶法 | D.分液法 E.渗析法 F.蒸馏法 G.过滤法 |
①___________分离饱和食盐水和沙子的混合物;
②___________从硝酸钾和氯化钠的混合溶液中获得硝酸钾;
③___________分离水和煤油的混合物;
④___________分离水和酒精。
铬铁矿的主要成分可表示为FeO·Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,以下是以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的流程图:
已知:①4FeO•Cr2O3+8Na2CO3+7O2 8Na2CrO4+2Fe2O3+8CO2↑;
8Na2CrO4+2Fe2O3+8CO2↑;
②Na2CO3+Al2O3 2NaAlO2+CO2↑;
2NaAlO2+CO2↑;
③Cr2CO72-+H2O 2CrO42-+2H+
2CrO42-+2H+
根据题意回答下列问题:
(1)固体X中主要含有______________(填写化学式);要检测酸化操作中溶液的pH是否等于4.5,应该使用_____________________(填写仪器或试剂名称);
(2)酸化步骤用醋酸调节溶液pH<5,其目的是_____________________;
(3)操作Ⅲ有多步组成,获得K2Cr2O7晶体的操作依次是:加入KCl固体、蒸发浓缩、________、过滤、_______、干燥;
(4)如表是相关物质的溶解度数据,操作III发生反应的化学方程式是:Na2Cr2O7+2KCl→K2Cr2O7+2NaCl,该反应在溶液中能发生的理由是_____________________;
| 物质 |
KCl |
NaCl |
K2Cr2O7 |
Na2Cr2O7 |
|
| 溶解度(g/100g水) |
0℃ |
28 |
35.7 |
4.7 |
163 |
| 40℃ |
40.1 |
36.4 |
26.3 |
215 |
|
| 80℃ |
51.3 |
38 |
73 |
376 |
(5)副产品Y主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,精确分析Y中氢氧化铝含量的方法是称取ng样品,加入过量________(填写试剂)、溶解、过滤、再质量分数为________(填写试剂)、…灼烧、冷却、称量,得干燥固体mg.计算祥品中氢氧化铝的________(用含m、n的代数式表示)。
已知:ICl的熔点为13.9℃,沸点为97.4℃,易水解,且能发生反应:ICl(l)+Cl2(g)=ICl3(l)
(1)装置A中发生反应的化学方程式是________________________________;
(2)装置B的作用是___________________,不能用装置F代替装置E,理由_______________________;
(3)所制得的ICl中溶有少量ICl3杂质,提纯的方法是___________(填标号);
| A.过滤 | B.蒸发结晶 | C.蒸馏 | D.分液 |
(4)用ICl的冰醋酸溶液测定某油脂的不饱和度.进行如下两个实验,实验过程中有关反应为:
①
②ICl+KI═I2+KCl
③I2+2Na2S2O3═2NaI+Na2S4O6
实验1:将5.00g该油脂样品溶于四氯化碳后形成100mL溶液,从中取出十分之一,加人20mL某ICl的冰醋酸溶液(过量),充分反应后,加人足量KI溶液,生成的碘单质用a mol•L-1的Na2S2O3标准溶液滴定.经平行实验,测得消耗的Na2S2O3溶液的平均体积为V1mL.
实验2(空白实验):不加油脂样品,其它操作步骤、所用试剂及用量与实验1完全相同,测得消耗的Na2S2O3溶液的平均体积为V2mL.
①滴定过程中可用___________作指示剂.
②滴定过程中需要不断振荡,否则会导致V1_________(填“偏大”或“偏小).
③5.00g该油脂样品所消耗的ICl的物质的量为___________mol,由此数据经换算即可求得该油脂的不饱和度。
甲乙两同学对保存已久的Na2SO3试剂进行试验探究。取适量Na2SO3样品于洁净烧杯中,加入适量蒸馏水,充分搅拌全部溶解。
(1)测上述溶液的PH值,其PH值>7,原因是(用离子方程式表示)
(2)取少量上述溶液于试管中,加入硝酸钡溶液生成白色沉淀,再加入盐酸,白色沉淀不溶解,甲认为已变质,乙认为他的结论不科学,理由是
(3)假设试剂由Na2SO3和Na2SO4组成,设计试验方案,进行成分检验,他们决定继续探究,请在答题卡上写出实验步骤、预期现象和结论。限选试剂及仪器:稀盐酸、稀硝酸、氯化钡溶液,品红溶液,酸性高锰酸溶液,NaOH溶液、澄清石灰水、pH计、烧杯、试管、带塞导气管、滴管
| 实验步骤 |
预期现象和结论 |
| 步骤1:取适量试剂于洁净烧杯中,加入足量蒸馏水,充分搅拌,静置。 |
|
| 步骤2:取适量步骤1所得溶液于试管中,加入少量的 溶液。 |
若溶液褪色,说明其有 若溶液不褪色,说明其中没有 |
| 步骤3:再取适量步骤1所得溶液于另一试管中,先加入足量的稀盐酸,再滴加 溶液。 |
如果有白色沉淀生成,则说明其中有 ,已经变质。 如果没有白色沉淀生成,则说明其中没有 |
(4)经实验检验后,确实已变质,现准确测定其中Na2SO3的含量。实验如下:
①配制250ml 约0.2mol•L-1 Na2SO3溶液:准确称取w克试样,置于烧杯中,加适量蒸馏水溶解,将溶液转入 ,洗涤,定容,摇匀。
②滴定:准确量取25.00ml Na2SO3所配制溶液于锥形瓶中,将 0.05mol•L-1酸性高锰酸钾装入50ml (填酸式或碱式)滴定管,滴定至终点,记录数据。重复滴定2次。平均消耗KMnO4VmL。
③计算Na2SO3的质量分数= (只列出计算式,不要求算出结果)
某校化学小组学生利用下图所列装置进行“铁与水反应”的实验,并利用产物进一步制取FeCl3·6H2O 晶体。(图中夹持及尾气处理装置均已略去)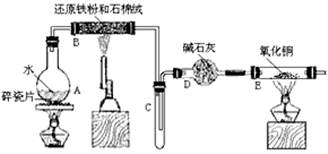
(1)烧瓶底部放置了几片碎瓷片,碎瓷片的作用是 。
装置B中发生反应的化学方程式是 ____________________________
(2)如果要在C处玻璃管处点燃该气体,则必须对该气体进行 ,装置E中的现象是
(3)停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤。简述检验滤液中Fe3+的操作方法 __________________________。
(4)该小组学生利用上述滤液制取FeCl3·6H2O晶体,设计流程如下: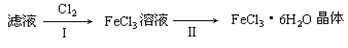
① 步骤I中通入Cl2的作用是____________________________。
② 步骤II从FeCl3稀溶液中得到FeCl3·6H2O晶体的主要操作包括:
现用质量分数为98%、密度为1.84g•cm3的浓H2SO4配制500mL、0.2mol•L-1的稀H2SO4.可供选择的仪器有:①玻璃棒②烧瓶③烧杯④药匙⑤量筒⑥容量瓶⑦托盘天平。
请回答下列问题:
(1)上述仪器中,在配制稀H2SO4时用不到的有____________(填代号).配制时还欠缺的仪器是___________。
(2)经计算,需浓H2SO4的体积为____________mL(精确到0.1)。
(3)配制过程有以下操作:
A移液 B量取 C洗涤D定容 E溶解F摇匀
其正确的操作顺序应是_________________(填序号)。
(4)在配制过程中,其他操作都准确,下列操作中,能引起误差偏高的有__________(填代号)
①洗涤量取浓H2SO4后的量筒,并将洗涤液转移到容量瓶中
②稀释后的H2SO4溶液未等冷却至室温就转移到容量瓶中
③定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线
④转移前,容量瓶中含有少量蒸馏水
⑤定容时,俯视标线
(5)从上述容量瓶中移取25.00mL的稀硫酸溶液于100mL的容量瓶,加水稀释至刻度线。请问所得溶液中c(H+)=____________。