(10分)一块表面已被氧化为氧化钠的钠块17.0g,投入到50g水中,最多能产生0.20g气体,则:(1)涉及的化学方程式 ,
(2)钠块中钠的质量是 ,
(3)钠块中氧化钠的质量是 ,
(4)原来钠块中被氧化的钠的质量是 ,
(5)设所得溶液的体积为50ml,求所得溶液溶质物质的量浓度是 。
乙烯是一种重要的化工原料,以乙烯为原料衍生出部分化工产品的反应如下(部分反应条件已略去):
请回答下列问题:
(1)A的化学名称是_______;
(2)B和A反应生成C的化学方程式为__________,
该反应的类型为_________;
(3)D的结构简式为___________;
(4)D的同分异构体的结构简式为___________。
为探究乙炔与溴的加成反应,甲同学设计并进行了如下实验:先取一定量工业用电石与水反应,将生成的气体通入溴水中,发现溶液褪色,即证明乙炔与溴水发生了加成反应。
乙同学发现在甲同学的实验中,褪色后的溶液里有少许淡黄色浑浊,推测在制得的乙炔中还可能含有少量还原性的杂质气体,由此他提出必须先除去之,再与溴水反应。
请你回答下列问题:
(1)写出甲同学实验中两个主要的化学方程式
、
(2)甲同学设计的实验(填能或不能)验证乙炔与澳发生加成反应,其理由是
(a)使溴水褪色的反应,未必是加成反应(b)使溴水褪色的反应,就是加成反应
(c)使溴水褪色的物质,未必是乙炔(d)使溴水褪色的物质,就是乙炔
(3)乙同学推测此乙炔中必定含有的一种杂质气体是,它与溴水反应的化学方程式是;在验证过程中必须全部除去。
(4)请你选用下列四个装置(可重复使用)来实现乙同学的实验方案,将它们的编号填入方框,并写出装置内所放的化学药品。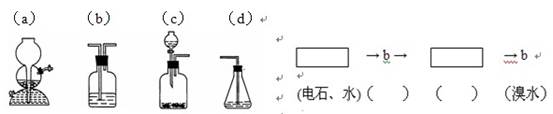
(1)以铜电极电解NaOH溶液,若产生1molH2,则消耗H2Omol。
(2)以铂电极电解饱和Na2CO3溶液,一段时间后溶液的浓度(增大、减小或不变),有无晶体析出?(有、无)。
(1)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知:N≡N键的键能是948.9kJ·mol-1,H-H键的键能是436.0kJ·mol-1;由N2和H2合成1molNH3时可放出46.2kJ的热量。N-H键的键能是。
(2)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-24.8kJ·mol-1
3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g)△H=-47.2kJ·mol-1
Fe3O4(s)+CO(g)==3FeO(s)+CO2(g)△H=+640.5kJ·mol-1
写出CO气体还原FeO固体得到Fe 固体和CO2气体的热化学反应方程式:
_________________。
830K时,在密闭容器中发生下列可逆反应:CO(g)+H2O(g)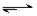 CO2(g)+H2(g)△H<0试回答下列问题:
CO2(g)+H2(g)△H<0试回答下列问题:
(1)若起始时c(CO)=2mol·L-1,c(H2O)=3mol·L-1,达到平衡时CO的转化率为60%,则在该温度下,该反应的平衡常数K=。
(2)在相同温度下,若起始时c(CO)=1mol·L-1,c(H2O)=2mol·L-1,反应进行一段时间后,测得H2的浓度为0.5 mol·L-1,则此时该反应是否达到平衡状态(填“是”与“否”),此时v(正)v(逆)(填“大于”“小于”或“等于”),你判断的依据是。
(3)若降低温度,该反应的K值将,该反应的化学反应速率将(均填“增大”“减小”或“不变”)。