相对分子质量为92的某芳香烃X是一种重要的有机化工原料,研究部门以它为初始原料设计出如下转化关系图(部分产物、合成路线、反应条件略去)。其中A是一氯代物,H是一种功能高分子,链节组成为C7H5NO。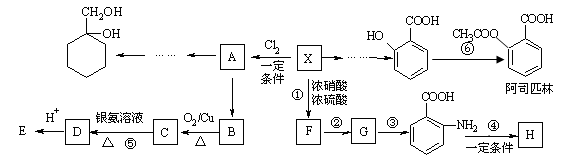
已知:
Ⅰ 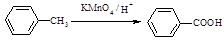
Ⅱ 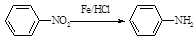 (苯胺,易被氧化)
(苯胺,易被氧化)
请根据所学知识与本题所给信息回答下列问题:
(1)H的结构简式是______________;(2)反应②的类型是______________;
(3)反应⑤的化学方程式是____________________________________________;
反应⑥的化学方程式是____________________________________________;
(4)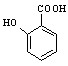 有多种同分异构体,其中符合下列条件的共有__________种
有多种同分异构体,其中符合下列条件的共有__________种
①能发生银镜反应但不能水解
②每摩尔同分异构体最多消耗2mol NaOH
③苯环上一氯代物只有两种
下列各组物质:

其中互为同位素的是_______;互为同素异形体的是_______;互为同系物的是_______;
互为同分异构体的是_______;属于同种物质的是_______。(用序号填空,下同)
(2)关于物质①K2O②CO2③NH4Cl ④C2H4⑤Na2O2⑥NaOH,请回答下列问题:仅含极性键和非极性键的化合物是_____;含有非极性键的离子化合物是_______。
(3)试计算烷烃中碳元素的质量分数的取值范围为_______。
已知X和Y均是元素周期表中同一主族元素的单质,W、V是化合物,它们有如下反应:(式中各物质的化学计量数及反应条件均已略去)X+W→Y+V
试写出符合题意且满足下列要求的化学方程式
① W是H2O:②V的水溶液是酸:
③W、V都是氧化物:④V是水:
A、B、C、D、E五种短周期元素,它们的原子序数依次增大。B原子的最外层电子数是其次外层电子数的2倍;A的一种原子中,质量数与质子数之差为零。D元素的原子最外层电子数为m,次外层电子数为n;E元素的原子L层电子数为m+n,M层电子数为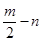 。请回答下列问题:
。请回答下列问题:
(1)D元素在周期表中的位置是_____________________;
(2)写出一个E和D形成的化合物与水反应的离子方程式_______________________;
(3)已知:甲 + H2O → 丙 + 丁。若甲是由N和Cl元素组成的化合物,其分子结构模型如右图所示,丙具有漂白性。则甲中Cl元素的化合价是 ,丁与H2O有相同的电子总数,则丁的化学式为。 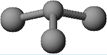
(4)与D同主族上下相邻的元素M、N,原子电子层数M>N>D,三种元素氢化物沸点由大到小的顺序是(填写化学式)。
(5)写出B与D在高温下完全反应后生成物的电子式___ __,结构式___
下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。
| a |
|||||||||||||||||
| b |
c |
d |
e |
f |
|||||||||||||
| g |
h |
i |
j |
k |
l |
m |
|||||||||||
| n |
o |
||||||||||||||||
试回答下列问题:
(1)请写出字母O代表的元素符号,该元素在周期表中的位置。
(2)第三周期8种元素按单质熔点高低的顺序如图,其中序号“8”代表(填元素符号);其中电负性最大的是(填右图中的序号)。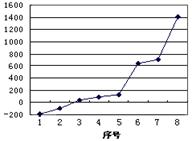
(3)由j原子跟c原子以1 : 1相互交替结合而形成的晶体,晶型与晶体j相同。两者相比熔点更高的是(填化学式),试从结构角度加以解释:。
(4)k与l形成的化合物kl2的电子式是,它在常温下呈液态,形成晶体时,属于
晶体。
(5)i单质晶体中原子的堆积方式如下图(甲)所示,其晶胞特征如下图(乙)所示,原子之间相互位置关系的平面图如下图(丙)所示。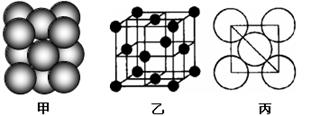
若已知i的原子半径为d,NA代表阿伏加德罗常数,i的相对原子质量为M,请回答:
晶胞中i原子的配位数为,一个晶胞中i原子的数目为,该晶体的密度为__________________(用M、NA、d表示)。
X、Y、Z、Q、E五种元素中,X原子核外的M层中有2个单电子且与Z同主族,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,Q的核电荷数是X与Z的核电荷数之和,E在元素周期表的各元素中电负性最大。请回答下列问题:
(1)X、Y的元素符号依次为、;
(2)YZ2分子的立体结构是;
(3)Q的元素符号是,它的核外电子排布式为,在形成化合物时它的最高化合价为;
(4)E的氢化物的熔沸点比同族其它元素氢化物的熔沸点都要高很多,原因是
。