设反应①Fe(s)+CO2(g)  FeO(s)+CO(g) ΔH=Q1的平衡常数为K1,反应②Fe(s)+H2O(g)
FeO(s)+CO(g) ΔH=Q1的平衡常数为K1,反应②Fe(s)+H2O(g) FeO(s)+H2(g) ΔH=Q2的平衡常数为K2,在不同温度下,K1、K2的值如下:
FeO(s)+H2(g) ΔH=Q2的平衡常数为K2,在不同温度下,K1、K2的值如下:
| 温度(T) |
K1 |
K2 |
| 973 |
1.47 |
2.38 |
| 1 173 |
2.15 |
1.67 |
(1)从上表可推断,反应①是________(填“放”或“吸”)热反应。
(2)现有反应③H2(g)+CO2(g) CO(g)+H2O(g) ΔH=Q的平衡常数为K3。
CO(g)+H2O(g) ΔH=Q的平衡常数为K3。
Ⅰ.根据反应①与②推导出K1、K2、K3的关系式K3=___ _____;可推断反应③是________(填“放”或“吸”)热反应。要使反应③在一定条件下建立的平衡右移,可采取的措施有________。
A.缩小容器体积 B.降低温度
C.使用合适的催化剂 D.设法减少CO的量
E.升高温度
Ⅱ.根据反应①与②推导出Q1、Q2、Q3的关系式Q3=________。
设水的电离平衡线如图3-4所示:(1)若以A点表示20 ℃时水在电离平衡时的离子浓度,当温度上升到100 ℃时,水的电离平衡状态到B点。则此时水的离子积______从增大到______。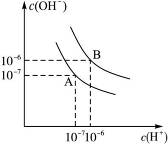
图3-4
(2)将100 ℃时pH=8的Ba(OH)2溶液与pH=5的稀H2SO4混合,并保持100 ℃的恒温。欲使混合液的pH=7,则Ba(OH)2与稀H2SO4的体积比为(二者混合后体积假设为二者体积之和)。
常温下,有pH=12的NaOH溶液100 mL,若将其pH变为11(溶液混合造成的体积变化忽略不计,计算结果保留小数点后一位)。
(1)若用pH=10的NaOH溶液,应加入 mL。
(2)若用pH=2的盐酸,应加入mL。
(3)若用0.01 mol·L-1的CH3COOH溶液V1 mL,则V1的取值范围为__________。
(4)若用pH=2的任意一元弱酸HR溶液V2 mL,则V2的取值范围为_________。
某温度下,纯水中由H2O电离出的c(H+)=2×10-7mol·L-1,则此时H2O电离出的c(OH-)=__________mol·L-1,该温度下,浓度为0.01 mol·L-1的NaOH溶液的pH=__________。
在25 ℃时,有pH=a(a≤6)的盐酸Va L和pH=b(b≥8)的NaOH溶液Vb L。二者混合恰好完全中和。问:
(1)若a+b=14时,则 =_________(填数值);
=_________(填数值);
(2)若a+b=13时,则 =_________(填数值);
=_________(填数值);
(3)若a+b>14时,则 =_________(填表达式),且VaVb(填“>”“<”或“=”)。
=_________(填表达式),且VaVb(填“>”“<”或“=”)。
有等体积、等物质的量浓度的氢硫酸和亚硫酸溶液各两份,分别通入Cl2和O2,溶液的pH变化(y)与通入气体的量x的关系如图3-6所示,则a、b、c、d分别所代表的pH变化与之对应的化学反应分别是:
图3-6
| A.在氢硫酸中通入O2_________________; |
| B.在亚硫酸中通入O2_________________; |
| C.在氢硫酸中通入Cl2_________________; |
| D.在亚硫酸中通入Cl2_________________。 |