(每空1分,共8分)实验室需要配制0.1 mol·L-1 CuSO4溶液480 mL。
按下列操作步骤填上适当的文字,以使整个操作完整。
(1)选择仪器。完成本实验所必需的仪器有:托盘天平(精确到0.1 g)、药匙、烧杯、玻璃棒、_______ _、________以及等质量的两片滤纸。
(2)计算,应选择下列正确________
| A.需要CuSO4 固体8.0g |
| B.需要CuSO4·5H2O晶体12.0 g |
| C.需要CuSO4·5H2O晶体12.5 g |
| D.需要CuSO4固体7.7 g |
(3)称量。所用砝码生锈则所配溶液的浓度会________(填“偏高”、“偏低”或“无影响”)。
(4)溶解、冷却,该步实验中需要使用玻璃棒,目的是_________________ 。
(5)转移、洗涤。在转移时应使用________引流,需要洗涤烧杯2~3次是为了______________________。
(6)定容,摇匀。
(7)将配好的溶液静置一段时间后,倒入指定的试剂瓶,贴好标签,注明配制的时间、溶液名称及浓度。
(8)在配制过程中,某学生观察定容时液面情况如图所示,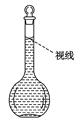
所配溶液的浓度会________(填“偏高”、“偏低”或“无影响”)。
某学生在做元素性质与原子结构的关系的实验时,设计了一套实验方案,并记录了有关的实验现象。请帮助该学生整理并完成实验报告。
(1)实验目的。
探究同一主族元素性质的递变规律。
(2)实验用品。
仪器:试管、胶头滴管。
药品:新制氯水、新制溴水、溴化钠溶液、碘化钠溶液、四氯化碳。
(3)实验内容(在下表横线中填写相关内容)。
| 序号 |
实验方案 |
实验现象 |
| ① |
向盛有少量溴化钠溶液的试管中滴加少量新制氯水,振荡,再加入少量四氯化碳,振荡后静置 |
液体分为两层,下层呈________色 |
| ② |
向盛有少量碘化钠溶液的试管中滴加少量新制溴水,振荡,再加入少量四氯化碳,振荡后静置 |
液体分为两层,下层呈________色 |
(4)实验结论:__________________________________________________________。
(5)问题和讨论。
①上述两个实验中发生反应的离子方程式分别为________、________。
②由于氟单质过于活泼,所以很难设计出一个简单的实验来验证其氧化性的强弱。试列举两项事实说明氟的非金属性比氯的强:________、________。
甲同学欲配制100 mL 3.6 mol/L的稀硫酸。
(1)若采用18 mol/L的浓硫酸配制该溶液,需要浓硫酸的体积为________mL;所选用容量瓶的规格为________mL。
(2)甲同学的配制步骤:量取浓硫酸,小心地倒入盛有少量水的烧杯中,搅拌均匀,待冷却至室温后转移到容量瓶中,用少量的水将烧杯等仪器洗涤2~3次,每次洗涤液也转移到容量瓶中,然后小心地向容量瓶中加水至刻度线定容,塞好瓶塞,反复上下颠倒摇匀。
①洗涤操作中,将洗涤烧杯后的溶液也注入容量瓶,其目的是________。
②定容的正确操作是继续加蒸馏水至离刻度线下________时,改用________加水至液面与刻度线相切。
③用胶头滴管往容量瓶中加水时,不小心液面超过了刻度,处理的方法是________(填字母序号,下同)。
A.吸出多余液体,使凹液面与刻度线相切
B.小心加热容量瓶,经蒸发后,使凹液面与刻度线相切
C.经计算加入一定量的浓硫酸
D.重新配制
(3)配制时下列操作会导致所配溶液浓度偏高的是________。
A.转移时有少量溶液溅出
B.定容时俯视读取刻度
C.容量瓶用蒸馏水洗净后未干燥
D.定容时液面超过了刻度线
某研究性学习小组的同学通过课外学习了解到:某品牌牙膏中含有摩擦剂、湿润剂、表面活性剂、黏合剂、香料、甜味剂等成分,其中的摩擦剂除了含CaCO3外,可能还含有Al(OH)3、SiO2中的一种或两种。为探究该品牌牙膏中摩擦剂的成分,该小组的同学进行了如下实验(牙膏中其他成分遇到盐酸时无气体产生):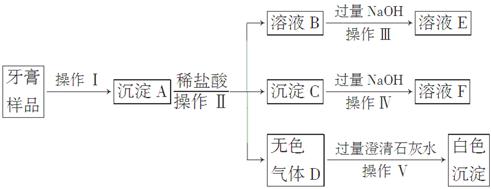
请回答下列问题:
(1)操作Ⅰ中涉及的玻璃仪器有烧杯、________、________。
(2)写出下列操作过程涉及的离子方程式:
操作Ⅲ:______________________________,
操作Ⅳ:______________________________。
(3)该摩擦剂中除CaCO3外,肯定含有__________________。
(4)为进一步探究摩擦剂中碳酸钙的含量,该小组同学利用如图所示装置(图中夹持仪器略去)进行实验。
请回答下列问题:
①实验过程中需持续缓缓通入空气。其作用除了可充分混合装置乙和丙中的反应物外,还有________的作用;
②丙中主要反应的化学方程式是________________;
③实验中准确称取4.00 g样品三份,进行三次测定,测得BaCO3的平均质量为1.97 g,计算样品中碳酸钙的质量分数(要求有计算过程):__________________________;
④有同学认为只要测定装置丙在吸收CO2前后的质量差,不必测定装置丙中生成的BaCO3质量,一样可以确定碳酸钙的质量分数。你认为该方案是否可行?________,简述理由:________。
某化学学习小组设计如图实验装置(夹持装置略去)制备Cl2,并探究氯气的相关性质。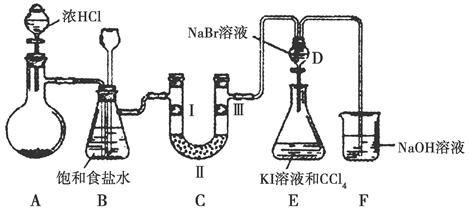
(1)若A装置中固体药品为KClO3,则反应中每生成1 mol Cl2时转移电子的物质的量为________mol。
(2)装置B既能除去氯气中的氯化氢,还能检测实验过程中装置C是否发生堵塞。若C中发生堵塞,B中将观察到的现象是________。
(3)装置C的作用是验证氯气是否具有漂白性,Ⅰ处是湿润的有色布条,则Ⅱ、Ⅲ处应加入的物质分别是____________________。
(4)设计装置D、E的目的是比较氯、溴、碘的非金属性。请简述能说明氯、溴、碘非金属性强弱的实验操作及现象:_______________。
(5)请用化学方程式说明装置F的作用:____________________。
(6)甲同学提出,装置F中的试剂可改用足量的Na2SO3溶液,乙同学认真思考后认为此法不可行。请用离子方程式解释乙认为不可行的原因:____________________________________。
某化学兴趣小组以木炭和浓硝酸为起始原料,探究一氧化氮与过氧化钠反应制备亚硝酸钠。设计装置如下(忽略装置中空气的影响),请回答下列问题: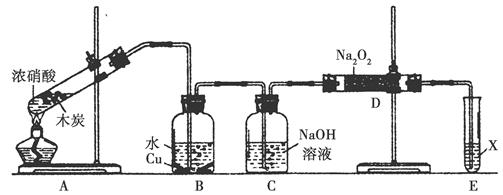
(1)组装好仪器后,必须进行的一项操作是_________________。
(2)装置A的试管中发生反应的化学方程式是_______________。
(3)推测B中可以观察到的主要现象是________;C装置的作用是________。
(4)装置D中除生成NaNO2外,还有另一种固态物质Y,Y的化学式是________;可以通过适当改进,不产生Y物质,请你提出改进方法:______________________。
(5)已知:亚硝酸是弱酸,不稳定,室温下存在反应3HNO2=HNO3+2NO↑+H2O;在酸性溶液中,NO2-可将MnO4-还原为Mn2+且无气体生成。
①写出检验D中产物是亚硝酸钠的方法:_________________;
②E装置中试剂X可以是________。
| A.稀硫酸 | B.酸性高锰酸钾溶液 |
| C.稀硝酸 | D.水 |