某温度下,反应X(g)+3Y(g) 2Z(g)的平衡常数为1 600。此温度下,
2Z(g)的平衡常数为1 600。此温度下,
在容积一定的密闭容器中加入一定量的X和Y,反应到某时刻测得各组分的浓度如下: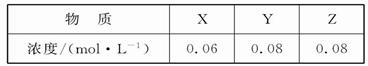
下列说法正确的是
| A.此时v(正)<v(逆) |
| B.平衡时Y的浓度为0.05 mol·L-1 |
| C.平衡时X的转化率为40% |
| D.增大压强使平衡向正反应方向移动,平衡常数增大 |
室温下,将33.6g铁片加到硝酸溶液中,两者全部参加反应,同时收集到11.2升气体(标准状况)下列说法正确的是( )
A.原溶液是浓硝酸,含HNO3的量为3.6mol
B.原溶液必是稀硝酸,含HNO3的量为2.4mol
C.原溶液必是稀硝酸,含HNO3的量为1.6mol~2.4mol
D原溶液必是稀硝酸,含HNO3的量为2.0mol
在做中和热实验测定中和热时,应使用的仪器正确组合是()
①天平;②量筒;③烧杯;④滴定管;⑤温度计;⑥试管;⑦酒精灯。
| A.①②④⑤ | B.②③⑤ | C.②③④⑦ | D.全部 |
已知热化学方程式2H2(g)+ O2(g)="=" 2H2O(l)△H1 = —571.6kJ·mol-1,则关于热化学方程式“2H2O(l)="=" 2H2(g)+ O2(g)△H2 = ?”的说法正确的是()
| A.方程式中化学计量数表示分子数 |
| B.该反应△H2大于零 |
| C.该反应△H2= —571.6kJ·mol-1 |
| D.该反应可表示36g水分解时的热效应 |
已知在101KPa,298K条件下,2 mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是()
| A.H2O(g)= H2(g)+ 1/2O2;△H(298K) = -242kJ·mol-1 |
| B.H2(g)+ 1/2O2(g)= H2O(l);△H(298K) = +484kJ·mol-1 |
| C.H2(g)+ 1/2O2(g)= H2O(g);△H(298K) = -242kJ·mol-1 |
| D.H2(g)+ 1/2O2(g)= H2O(g);△H(298K) = -484kJ |
由图分析可知下列说法正确的是()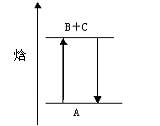
| A.A→B+C和B+C→A两个反应吸收或放出能量不等 |
| B.A→B+C△H < 0 |
| C.A具有的焓高于B和C具有的焓总和 |
| D.A→B+C△H > 0,则B+C→A△H < 0 |