为验证卤素单质氧化性的相对强弱,某小组用下图所示装置进行试验(夹持仪器已略去,气密性已检验)。
实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为棕色时,关闭活塞a。
Ⅳ.打开活塞b,将少量C中溶液滴入D中,然后关闭活塞b,……
(1)已知2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,该反应常用于实验室常温下制氯气。请用双线桥法标出此反应中电子转移的方向与数目,若该反应中生成标准状况下的氯气体积共0.112 L,则转移的电子数目为 。
(2)验证氯气的氧化性强于碘的实验现象是 。
(3)B中溶液发生反应的化学方程式是 。
(4)为验证溴的氧化性强于碘,过程Ⅳ还需补充的操作为 。可观察到的现象是 。
(5)D中溶液发生反应的化学方程式是 。
工业上将纯净干燥的氯气通入到物质的量浓度为0.375mol/LNaOH溶液中得到漂水。某同学想在实验室探究Cl2性质
并模拟制备漂水,下图是部分实验装置。已知KMnO4与盐酸溶液反应可以制取Cl2。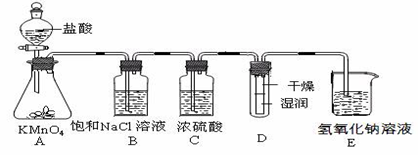
(1)配制物质的量浓度为0.375 mol/LNaOH溶液时,主要用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、量筒和 。
(2)浓硫酸的作用是 。
(3)装置E中发生化学反应的离子方程式为 。
(4)装置B中饱和NaCl溶液可用于除去Cl2中的HCl气体,已知氯气与水的反应是一个可逆反应,请简述饱和NaCl溶液除去Cl2
中HCl气体的原理(用离子方程式表示和文字说明) 。
(5)实验时装置D中湿润的红色纸条褪色,干燥部分没有褪色,放置一段时间后,纸条全部褪色。该同学认为Cl2的密度比空气大,
可能是试管下部Cl2的浓度大于试管上部Cl2的浓度所导致的。请判断该解释是否合理,并分析产生上述实验现象的原因 ;
如需改进,请简述设计方案 (若认为合理。则此问可不答)。
实验室合成乙酸乙酯的步骤如下:在圆底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸气冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏,得到含有乙醇、乙酸和水的乙酸乙酯粗产品。
请回答下列问题:
(1)在烧瓶中除了加入乙醇、浓硫酸和乙酸外,还应放入__________,目的是__________。
(2)反应中加入过量的乙醇,目的是__________________________。
(3)如果将上述实验步骤改为在蒸馏烧瓶内先加入乙醇和浓硫酸,然后通过分液漏斗边滴加乙酸,
边加热蒸馏。这样操作可以提高酯的产率,其原因是__________________________
(4)现拟分离粗产品乙酸乙酯、乙酸和乙醇的混合物下列框图是分离操作步骤流程图:
则试剂a是:____________,分离方法I是____________,分离方法II是____________,
试剂b是______________,分离方法III是______________。
(5)甲、乙两位同学欲将所得含有乙醇、乙酯和水的乙酸乙酯粗产品提纯,在未用指示剂的情况下,他们都是先加NaOH溶液中和酯中过量的酸,然后用蒸馏法将酯分离出来。甲、乙两人实验结果如下:
甲得到了显酸性的酯的混合物
乙得到了大量水溶性的物质
丙同学分析了上述实验目标产物后认为上述实验没有成功。
试解答下列问题:
①甲实验失败的原因是:_______________________________________________
②乙实验失败的原因是:_______________________________________________
某化学实验小组同学利用以下装置制备氨气,并探究氨气的性质(部分仪器已略去)。
请回答:
(1)实验室制备氨气的化学方程式为;干燥氨气常用的干燥剂是。
(2)收集氨气时,请你选择氨气的进气口(填“a”或“b”),理由是。
(3)若观察到装置B中的烧瓶内产生了红色喷泉,则说明氨气具有的性质是。
(4)为防止环境污染,以下装置(盛放的液体均为水)可用于吸收多余氨气的是(填序号)。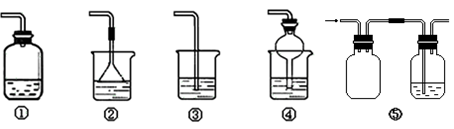
(5)氨气在催化剂并且加热时会被空气氧化,这是工业制硝酸的第一步反应,写出该反应的化学方程式。
某化学兴趣小组的同学设计了一套实验方案探究元素周期表中元素性质的变化规律;同一周期内从左到右元素金属性的递变规律;同一主族内从上到下元素非金属的递变规律。
| 实验方法(Ⅰ) |
实验现象(Ⅱ) |
| 1、钠与冷水反应 |
a、溶液变红色 |
| 2、向NaOH溶液中滴加酚酞 |
b、产生白烟 |
| 3、向新制H2S饱和溶液滴加新制的氯水 |
c、反应不十分剧烈,产生的气体能燃烧,溶液变成[ 浅红色。与酸反应剧烈,产生大量气泡且可以燃烧 |
| 4、镁带在空气中燃烧 |
d、产生大量气泡、气体可以燃烧 |
| 5、NaI溶液中加入溴水和CCl4 |
e、下层溶液变橙色 |
| 6镁带与沸水反应,再向反应后溶液中滴 加酚酞。镁与2mol/L盐酸反应。 |
f、浮于水面,熔成小球,迅速向四处游动 |
| 7、蘸浓氨水与浓盐酸的两玻璃棒接近 |
g、下层溶液变紫色 |
| 8、NaBr溶液中加入氯水和CCl4 |
h、发出耀眼的强光,生成白色物质 |
| 9、铝片与2mnol/L盐酸反应 |
i、生成淡黄色沉淀 |
回答下列问题
(1)从上表(Ⅰ)中选择实验方法,从(Ⅱ)中选择相应的实验现象,上下对应地填写符合要求的答案在空格中(有几个填几个,不一定把空格填满)。
| 1、探究同一周期从左到右元素金属性的递变规律 |
2、探究同一主族内从上到下元素非金属性的递变规律 |
|||||||
| Ⅰ |
||||||||
| Ⅱ |
(2)实验结论(表示元素具体的强弱顺序):金属性:____________________非金属性:
(3)上表(Ⅰ)中实验方法9反应的离子方程式
(4)上表(Ⅱ)中实验现象e反应的离子方程式
1,2-二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度2.18g/cm3,沸点131.4℃,熔点9.79℃,不溶于水、易溶于醇、醚、丙酮等有机溶剂。在实验中可以用下图所示装置制备1,2-二溴乙烷。其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管d中装有浓溴(表面覆盖少量水)。请填写下列空白:
⑴烧瓶a中发生的是乙醇制取乙烯的反应,写出该反应的化学方程式:。
⑵写出制备1,2-二溴乙烷的化学方程式:。
⑶安全瓶b可以防倒吸,并可以检查实验进行时试管d是否发生堵塞。请写出发生堵塞时瓶b中的现象:。
⑷锥形瓶c中NaOH溶液的作用是:。
⑸某学生做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正常情况下超出许多,如果装置的气密性没有问题,试分析其可能的原因。