(本题共12分)氰酸(化学式:HOCN)是一种有挥发性和腐蚀性的液体,在水中立刻发生如下反应形成盐X(俗名碳铵):HOCN + 2H2O → X。
23.在上述反应所涉及的各元素中,半径最大的元素原子核外电子共占据_______个轨道。
24.能说明氮元素的非金属性比碳元素强的事实是_________(选填编号)。
A.共用电子对偏向:H-N>H-C B.氧化性:NO2>CO2
C.酸性:HNO3>H2CO3 D.沸点:NH3>CH4
25.据测定,氰酸有两种结构,一种分子内含有叁键,称为正氰酸,另一种分子内不含叁键,称为异氰酸,且两种结构中所有原子最外层均已达到稳定结构,分子中也不含环状结构。请分别写出正氰酸和异氰酸的结构式:_______________、______________。
26.下面是工业上冶炼Cr时会涉及到的反应:
CrO42-+ S+ H2O → Cr(OH)3↓+ S2O32-+
(1)请将方程式补充完整并配平。
(2)上述反应中,若转移了3mol电子,得到的还原产物是 mol。
27.铁和镍(Ni)位于周期表的同一周期同一族,铁和镍在 周期 族。
28.镍粉在CO中低温加热,生成无色挥发性液态Ni(CO)4,呈四面体构型。150℃时,Ni(CO)4分解为Ni和CO。Ni(CO)4是 晶体,Ni(CO)4易溶于下列 (填序号)。
A.水 B.四氯化碳 C.苯 D.硫酸镍溶液
有一白色固体混合物,可能含有K+、Ba2+、Ag+、Mg2+、NH4+、Na+、SO42-、SO32-、CO32-、AlO2--等10种离子中的几种。为了鉴定其中的离子,现进行如下实验,根据实验现象,填写下列空格:
(1)取该粉末,加水后得到无色溶液,且未嗅到气味;用pH试纸测得溶液的pH为12。据此可以排除的离子有;
(2)向溶液中滴加盐酸溶液,开始有沉淀生成,继续滴加,沉淀消失,同时有无色无味气体逸出。可以判断肯定存在的离子有;可以排除的离子有,排除的依据是。
(3)不能确定的阳离子有,简述检验的方法(操作、现象、结论)。
原子序数小于36的X、Y、Z、W四种元素,其中X是周期表中半径最小的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29。回答下列问题:
(1)1mol Y2X2含有σ键的数目为。
(2)化合物ZX3的沸点比化合物YX4的高,其主要原因是。
(3)元素Y的一种氧化物与元素Z的一种氧化物互为等电子体,元素Z的这种氧化物的分子式是。
(4)元素W的一种氯化物晶体的晶胞结构如图13所示,该氯化物的化学式是。
T、X、Y、Z、Q、R、W为周期表前四周期元素,原子序数依次递增。已知:
①W的原子序数为29,其余的均为短周期主族元素;
②T原子所处的周期数、族序数分别与其原子序数相等;
③X的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子数相同;
④Z的基态原子价电子排布为ns2npn+2;
⑤在该元素所在周期中,Q的基态原子的第一电离能最小;
⑥R的单质常温常压下是气体,其基态原子的M层上有1个未成对的p电子;
(1)X、Y、Q三种元素的电负性由大到小的顺序是(用元素符号表示)。
(2)Y的氢化物分子间能形成氢键,R的氢化物分子间不易形成氢键,原因是 。
(3)W的基态原子的核外电子排布式为 。
(4)T、X、Z三种元素组成的一种化合物M是新装修居室中常见的有害气体,它的分子式为XT2Z,分子空间构型为平面三角形,1molM分子中σ键和π键的个数比为。
(5)X与Y原子结合形成的X3Y4晶体,其晶体结构与金刚石类似,但硬度比金刚石大,请解释原因是。
(10)(1)氯碱工业是利用电解食盐水生产①为基础的工业体系。
(2)电解前,为除去食盐水中的Mg2+、Ca2+、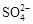 等杂质离子,下列加入顺序合理的是②。
等杂质离子,下列加入顺序合理的是②。
| A.碳酸钠、氢氧化钠、氯化钡 | B.碳酸钠、氯化钡、氢氧化钠 |
| C.氢氧化钠、碳酸钠、氯化钡 | D.氯化钡、氢氧化钠、碳酸钠 |
(3)“盐泥”是粗盐提纯及电解食盐水过程中形成的工业“废料”。某工厂的盐泥组成如下:
| 成分 |
NaCl |
Mg(OH)2 |
CaCO3 |
BaSO4 |
其他不溶于酸的物质 |
| 质量分数(%) |
15~20 |
15~20 |
5~10 |
30~40 |
10~15 |
为生产七水硫酸镁,设计了以下工艺流程: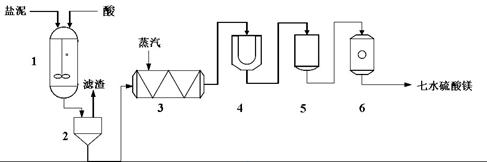
生产七水硫酸镁工艺流程图
1-反应器 2-过滤器 3-蒸发浓缩器 4-结晶槽 5-洗涤槽 6-真空干燥器
装置1中加入的酸应选用③,加入的酸应适当过量,控制pH为5左右,反应温度在50℃左右。持续搅拌使之充分反应,以使Mg(OH)2充分溶解并转化为MgSO4,在此过程中同时生成CaSO4。其中碳酸钙可以转化为硫酸钙的原因是④。
装置2中滤渣的主要成分为⑤。
装置3中通入高温水蒸汽并控制温度在100~110℃,蒸发结晶,此时析出的晶体主要是__⑥__。
用装置6(真空干燥器)干燥七水硫酸镁晶体的理由是⑦。
(10)(1)可正确表示原子轨道的是:①。
A.2s B.2d C.3pz D.3f
(2)写出原子序数31的基态镓(Ga)原子的电子排布式:②。
(3)下列物质变化,只与范德华力有关的是③。
A.干冰熔化 B.乙酸汽化
C.乙醇与丙酮混溶 D.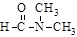 溶于水
溶于水
E.碘溶于四氯化碳 F.石英熔融
(4)下列物质中,只含有极性键的分子是④,既含离子键又含共价键的化合物是⑤,
只存在σ键的分子是⑥,同时存在σ键和π键的分子是⑦。
A.N2 B.CO2 C.CH2Cl2 D.C2H4 E.C2H6 F.CaCl2 G.NH4Cl
(5)用“>” “< ” “=” 填空:
第一电离能的大小:Mg⑧Al;熔点的高低:KCl⑨MgO。