近年来雾霾天气多次肆虐我国部分地区。其中燃煤和汽车尾气是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为:2NO(g) + 2CO(g) 2CO2(g)+ N2(g) 。在密闭容器中发生该反应时,c(CO2)随温度(T)和时间(t)的变化曲线如图1所示。据此判断:
2CO2(g)+ N2(g) 。在密闭容器中发生该反应时,c(CO2)随温度(T)和时间(t)的变化曲线如图1所示。据此判断:
①该反应的△H 0(填“<”或“>”)。
②在T2温度下,0~2s内的平均反应速率v (N2)为 。
③若降低温度,将NO2(g)转化为N2O4(l),已知:2NO2(g) N2O4(g)ΔH1 2NO2(g)
N2O4(g)ΔH1 2NO2(g) N2O4(l)ΔH2 ;下列能量变化示意图2中,正确的是(选填字母) 。
N2O4(l)ΔH2 ;下列能量变化示意图2中,正确的是(选填字母) 。 

图1 图2
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。煤燃烧产生的烟气中含氮的氧化物,某化学课外小组用CH4可以消除NOX对环境的污染。已知:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g);△H<0
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);△H=-1160KJ/mol
现有某NO2、NO的混合气体,同温同压下密度是氢气的17倍,用16g CH4恰好完全反应生成N2、CO2(g)、H2O(g),放出热量1042.8KJ。则△H为( )
| A.-925.6KJ/mol | B.-867 KJ/mol | C.-691.2 KJ/mol | D.-574 KJ/mol |
 (3)甲烷燃料电池可以提升能量利用率。下图是利用甲烷燃料电池电解100mL 1 mol/L食盐水的装置,电解一段时间后,收集到标准状况下的氢气2.24L(设电解后溶液体积不变)。
(3)甲烷燃料电池可以提升能量利用率。下图是利用甲烷燃料电池电解100mL 1 mol/L食盐水的装置,电解一段时间后,收集到标准状况下的氢气2.24L(设电解后溶液体积不变)。
①该燃料电池的负极反应式为 。
②电解后溶液的pH约为 (忽略氯气与氢氧化钠溶液反应)。
按下列要求填空:
(1)现有下列物质: ①蔗糖②碳酸钙固态③NH3④ 硫酸⑤ 醋酸⑥ 酒精水溶液⑦NaOH水溶液⑧ 熔融NaC l
其中属于强电解质的是;属于非电解质的是;能导电的是。
(2)写出下列物质在水溶液中的电离方程式:
①碳酸:②碳酸氢钠:
(3)室温下,往0.1mol/L的氨水中滴入酚酞溶液时,溶液呈粉红色,要使溶液颜色变浅,可采取以下哪些措施 。
| A.加水 | B.加固体氯化铵 | C.加固体氢氧化钠 | D.加浓盐酸 |
(4)已知一元酸HA在一定温度下的电离平衡常数K=1.6×10-5,初始浓度为1mol/L的HA的电离度约为 。
(5)某温度下,纯水中KW=9×10-14mol/L,此温度下,向水中加入氢氧化钠,使c(OH―)=5.0×10-5mol/L,则由水电离出得c(OH―)是。
氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为MgCO3,含少量FeCO3 )为原料制备高纯氧化镁的实验流程如下:
(1)MgCO3与稀硫酸反应的离子方程式为。
(2)加入H2O2氧化时,发生反应的化学方程式为。
(3)滤渣2的成分是(填化学式)。
(4)煅烧过程存在以下反应:
2MgSO4+C 2MgO+2SO2↑+CO2↑ MgSO4+C
2MgO+2SO2↑+CO2↑ MgSO4+C MgO+SO2↑+CO↑
MgO+SO2↑+CO↑
MgSO4+ 3C MgO+S↑+3CO↑
MgO+S↑+3CO↑
利用右图装置对煅烧产生的气体进行分步吸收或收集。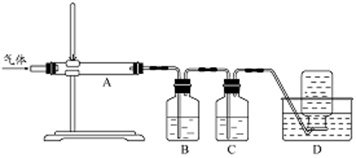
①D中收集的气体可以是(填化学式)。
②B中盛放的溶液可以是(填字母)。
| A.NaOH溶液 | B.Na2CO3溶液 | C.稀硝酸 | D.KMnO4溶液 |
③A中得到的淡黄色固体与热的NaOH溶液反应,产物中硫元素最高价态为+4,写出该反应的离子方程式:。
新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2 ,电解质为KOH溶液。某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验,如图所示。
回答下列问题:
(1)甲烷燃料电池正极、负极的电极反应分别为、。
(2)闭合K开关后,a、b电极上均有气体产生.其中b电极上电极反应式为;
(3)若每个电池甲烷通入量为 1 L(标准状况),且反应完全,则理论上最多能产生的氯气体积
为L (标准状况)。
五种短周期元素A、B、C、D、E原子序数依次增大,结合下列信息:
(1)A原子核外电子总数是内层电子数的三倍,A、E同主族
(2)B的最高价氧化物对应的水化物F与其气态氢化物G反应,得到离子化合物H。
(3)C的焰色应呈黄色。
(4)D在同周期主族元素形成的简单离子中,离子半径最小.
回答下列问题:
(1)写出D在元素周期表中的位置:
(2)化合物H的水溶液pH 7 其原因是(用离子方程式表示)
(3)上述元素的最高价氧化物对应的水化物中,有一种物质在一定条件下均能与其他四种物质发生化学反应,写出该物质的电子式
(4)某同学设计实验证明A、B、E的非金属性强弱关系。
①溶液a和b分别为,。
②溶液c中的离子方程式为。
X、Y、Z、R为前四周期元素,且原子序数依次增大。XY2是红棕色气体;X与氢元素可形成XH3;Z基态原子的M层与K层电子数相等;R2+离子的3d轨道中有9个电子。请回答下列问题:
(1)Y基态原子的电子排布式是;Z所在周期中第一电离能最大的元素是。
(2)XY2- 离子的立体构型是;R2+的水合离子中,提供孤电子 对的原子是。
(3)Z与某元素形成的化合物的晶胞如下图所示,晶胞中阴离子与阳离子的个数比是。
(4)将R单质的粉末加入XH3的浓溶液中,通入Y2,充分反应后溶液呈深蓝色,该反应的离子方程式是。