A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
| 阳离子 |
Ag+ Na+ |
| 阴离子 |
NO3- SO42- Cl- |
下图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A、 B、 C三种溶液,电极均为石墨电极。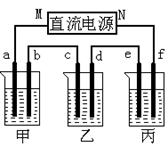
接通电源,经过一端时间后,测得乙中C电极质量增加了27克。常温下各烧杯中溶液的pH与电解时间t的关系图如下。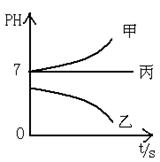
据此回答下列问题:
(1)M为电源的_______极(填写“正”或“负”),甲、乙电解质分别为_______、_______(填写化学式)。
(2)f电极的电极反应式为 ,生成的气体在标准状况下的体积为_____________。
(3)写出乙烧杯的电解池反应_____________________________。
(4)若电解后甲溶液的体积为25L,则该溶液的pH为___________ 。
(5)要使丙恢复到原来的状态,应加入_____ __ g 。(填写化学式)
(10分)按照下图连接线路,反应一段时间后,回答下列问题(假设原电池所提供的电能可以保证电解反应的顺利进行):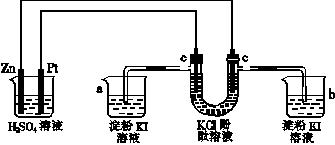
(1)写出U形管内出现的现象:右侧管 。
(2)写出有关反应的化学方程式: 、
、 。
(3)写出a烧杯中出现的现象: 。
氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法。
(1)已知:H—H键能为436 kJ/mol, N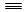 N键能为945 kJ/mol,N—H键能为391 kJ/mol。写出工业合成氨反应的化学方程式;由键能计算说明此反应是反应(填“吸热”或“放热”),合成氨反应(消耗1molN2 时)的△H =。
N键能为945 kJ/mol,N—H键能为391 kJ/mol。写出工业合成氨反应的化学方程式;由键能计算说明此反应是反应(填“吸热”或“放热”),合成氨反应(消耗1molN2 时)的△H =。
(2)恒温下,向一个2L的密闭容器中充入1 mol N2和2.6 mol H2,反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
| 时间/min |
5 |
10 |
15 |
20 |
25 |
30 |
| c(NH3)/(mol/L) |
0.08 |
0.14 |
0.18 |
0.20 |
0.20 |
0.20 |
5min内,用N2浓度的变化表示的反应速率为,此条件下, 反应达到平衡的时间为:,其化学平衡常数K=;达到平衡后氨气的转化率为:。
J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如右表;J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素。
(1)M的离子结构示意图为_____;元素T在周期表中位于第_____周期第_____族。
(2)J和氢组成的化合物分子有6个原子,其结构简式为。
(3)M和T形成的化合物在潮湿的空气中冒白色烟雾,反应的化学方程式为。
已知有以下物质相互转化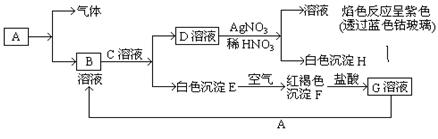
试回答:(1)写出B的化学式D的化学式。
(2)写出由E转变成F的化学方程式。
(3)写出用KSCN鉴别G溶液的离子方程式;
向G溶液加入A的有关离子反应方程式。
| J |
||||
| R |
过硫酸钾(K2S2O8)的氧化性强于KMnO4,某反应在银离子催化下可发生,该反应体系中的物质有:K2S2O8、、KMnO4、K2SO4 、 MnSO4、H2SO4、 H2O。
(1)请写出并配平上述反应的化学方程式:
(2)反应中被还原的物质是:;还原剂是:。