已知在25 ℃时,醋酸、碳酸、次氯酸、氢硫酸和亚硫酸的电离平衡常数分别为
CH3COOH:Ka=1.8×10-5
H2CO3:Ka1=4.3×10-7 Ka2=5.6×10-11
HClO:Ka=3.0×10-8
H2S:Ka1=9.1×10-8 Ka2=1.1×10-12
H2SO3:Ka1=1.5×10-2 Ka2=1.0×10-7
(1)写出碳酸的第二级电离平衡常数表达式Ka2=__________。
(2)在25 ℃时,相同物质量浓度的上述四种酸溶液中,氢离子浓度最大的是 (填“醋酸”、“碳酸”、“次氯酸”、“氢硫酸”或“亚硫酸”,下同);水电离的氢离子浓度最大的是 。
(3)在25 ℃时,饱和氢硫酸溶液的物质的量浓度约为0.1mol·L-1,用广泛pH试纸测定其pH值的操作方法是: ;若此时测得溶液的pH=4,则此时氢硫酸的电离度= ;加水稀释饱和氢硫酸溶液,下列数值增大的是 。
A.c(HS-)
B.c(OH-)
C.c(H+)·c(OH-)
D.n(H+)·n(OH-)
E.c(HS-)/c(H2S)
(4)下列离子方程式中正确的是________。
A.少量CO2通入次氯酸钠溶液中:CO2+H2O+ClO-===HCO+HClO
B.少量SO2通入次氯酸钙溶液中:Ca2++2ClO-+SO2+H2O===CaSO3↓+2HClO
C.过量SO2通入碳酸钠溶液中:2SO2+H2O+CO32-===2HSO3-+CO2
D.过量CH3COOH加入碳酸钠溶液中:CH3COOH+CO32-===CH3COO-+HCO3-
据中央电视台新闻报道,某知名品牌保健食品补钙剂经检测,H2O2含量超标,试回答下列问题.
(1)该品牌保健食品属于________的保健食品。
A.强化营养人群
B.特殊人群
C.健康异常人群
(2)试推测该保健食品中钙以________的方式存在。
A.钙单质B.Ca(OH)2 C.CaCO3D.乳酸钙
(3)试写出超标的H2O2的电子式________。
(4)某成年女子,经化验知缺铁,如果该女子也使用补铁保健食品,能否与该品牌保健食品同时食用________,如果不能,试用化学方程式表示其原因__________________________。
某种甜味剂A的甜度是蔗糖的200倍,由于它热值低、口感好、副作用小,已在90多个国家广泛使用。A的结构简式为: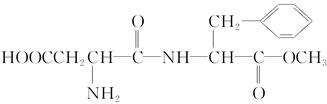
已知:①在一定条件下,羧酸酯或羧酸与含—NH2的化合物反应可以生成酰胺,如: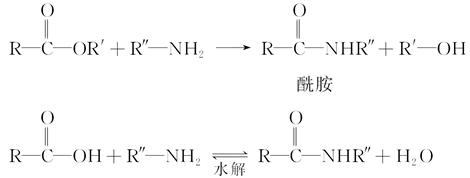
②酯比酰胺容易水解。请填写下列空白:
(1)在稀酸条件下加热,化合物A首先生成的水解产物是________和________。
(2)在较浓酸和长时间加热条件下,化合物A可以水解生成________、________和________。
(3)化合物A分子内的官能团之间也可以发生反应,再生成一个酰胺键,产物是甲醇和________________。(填写结构简式,该分子中除苯环以外,还含有一个六原子组成的环)。
某有机物含碳、氢、氧、氮四种元素。如图是该有机物的球棍模型(其中黑点表示原子,短线表示原子之间的共价键),则该有机物的化学式为________________________。
写出该有机物的一种同分异构体,它的分子中含有两个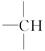 ,且是天然蛋白质水解的最终产物之一,则该同分异构体的结构简式为_____________________________________。
,且是天然蛋白质水解的最终产物之一,则该同分异构体的结构简式为_____________________________________。
下面是关于药物华素片(西地碘片)使用说明书中的部分内容:
(1)根据上述说明和所学化学知识回答。
①华素片中含有的活性成分是________(写分子式);
②请推断华素片________(“是”或“不是”)白色。
(2)某学生为验证华素片中确实含有上述成分,设计实验如下,请填写空格。
①取一粒药片放入研钵中研碎,再将药粉装入试管并加入约2 mL蒸馏水。
向该试管中再加入约2 mL________(填选项字母),并用力振荡。
| A.酒精 | B.热裂汽油 |
| C.四氯化碳 | D.甘油 |
②描述加入该液体后可能观察到的现象______________________________。
③选用该液体做实验的原因是____________________________________________。
(3)还可以用另一种试剂验证华素片中的成分,试剂是________,现象是____________________________________。
铁元素是人体的重要营养元素,铁在人体内的主要功能是以血红蛋白(含低价铁)的形式参加氧的转运、交换和组织呼吸过程,以及在体内用于生产供给生命活动需要的细胞能量ATP。
(1)人体正常的血红蛋白应该含Fe2+。若误食亚硝酸盐(如NaNO2),则导致血红蛋白中Fe2+转化成Fe3+而中毒,服用维生素C可解毒。下列叙述中正确的是 ( )。
| A.亚硝酸盐是还原剂 |
| B.维生素C是还原剂 |
| C.维生素C将Fe3+还原为Fe2+ |
| D.亚硝酸盐被氧化 |
(2)乳酸可以与精制铁粉制备一种药物,反应式为:2CH3CH(OH)COOH+Fe =[CH3CH(OH)COO]2Fe+H2↑在该反应中,氧化剂是________,还原剂是________,产物乳酸亚铁可以治疗的疾病是____________。
(3)举一例说明铁元素在人体中的重要作用___________________________。