有一未知的无色溶液,只可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH4+、K+、Mg2+、Cu2+、Al3+、NO3-、CO32-、SO42-,现取三份100mL溶液进行如下实验:
①第一份加足量AgNO3溶液后,有白色沉淀产生。
②第二份加足量BaCl2溶液后,有白色沉淀产生,经洗涤、干燥后,沉淀质量为6.99 g。
③第三份逐滴滴加NaOH溶液,测得沉淀与NaOH溶液的体积关系如图。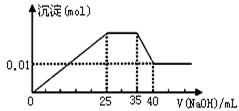
试回答下列问题:
(1)该溶液中一定不存在的阴离子有 。
(2)实验③中NaOH溶液滴至35 mL后发生的离子
方程式为 。
(3)通过实验和计算,填写下表中各阳离子的浓度(能计算出的,填写计算结果,一定不存在的离子填“0”,不能确定是否存在的离子填“?”)
| 离子 |
H+ |
NH4+ |
K+ |
Mg2+ |
Cu2+ |
Al3+ |
| c/mol·L-1 |
|
|
|
|
|
|
(4)若该溶液中不存在不能确定的阳离子,本小题不做。若存在,请设计实验方案加以检验 。
(5)判断NO3-是否存在,若存在求其最小浓度,若不存在说明理由 。
(6)实验所加的NaOH溶液的浓度为 (保留3个有效数字)。
在生活中根据不同的分类标准可以将分散系分为各种类型,例如根据分散质不同可将分散系分为溶液、胶体和浊液,其中分散质微粒的直径在之间的分散系叫做胶体,胶体有很强的吸附能力,在日常生活中通常作为剂。
( 30分 )(1)3.6克H2O的物质的量是,含有个H2O,含有molH.
(2)在同温同压下,同体积的甲烷(CH4)和二氧化碳分子数之比为 ,物质的量之比为 ,原子总数之比为 ;质量之比为 。
(3)在标准状况下,22g CO2气体的体积是L ,与g N2含有相同的分子数。
(4)3.01×1023个OH—的物质的量为,质量为,含有质子的物质的量为 ,含有电子的物质的量为,这些OH—与molNH3的质量相同,和g Na+含有的离子数相同。
,含有电子的物质的量为,这些OH—与molNH3的质量相同,和g Na+含有的离子数相同。
(13分)科学家预言,燃料电池将是21世纪获得电力的重要途径。一种乙醇燃料电池是采用铂或碳化钨作为电极催化剂,在氢氧化钾溶液的电解液中直接加入纯化后的乙醇,同时向一个电极通入空气。回答下列问题:
(1)这种电池放电时发生的化学反应方程式是_____________________________。
(2)此电极的正极发生的电极反应式是__________________________________;
负极发生的电极反应式________________________________。
(3)电解液中的K+离子向______极移动;向外电路释放电子的电极是_____极。
铅蓄电池 是化学电源,其
是化学电源,其 电极材料分别是Pb和PbO2,电解质溶液为稀硫酸。工作时,该电池的总反应为PbO2+Pb+2H2SO4=2PbSO4+2H2O,根据上述情况判断:
电极材料分别是Pb和PbO2,电解质溶液为稀硫酸。工作时,该电池的总反应为PbO2+Pb+2H2SO4=2PbSO4+2H2O,根据上述情况判断:
(1)蓄电池的负极是______,其电极反应式为______________________________。
(2)蓄电池的正极电极反应式为_________________________________。
(3)蓄电池工作时,其中电解质溶液的pH______(增大、减小、不变)。
已知:在298K、100kPa时,
①C(s,石墨)+O2(g) = CO2(g) △H1 = -400 kJ·mol-1;
②2H2(g)+O2(g) = 2H2O(l) △H2 = -570 kJ·mol-1;
③2C2H2(g)+5O2(g) = 4CO2(g)+ 2H2O(l) △H3 = -2600 kJ·mol-1;
写出298K时由C(s,石墨)和H2(g)生成1 mol C2H2(g)反应的热化学方程式 。
。