甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)===CO2(g)+3H2(g) ΔH=+49.0 kJ/mol
②CH3OH(g)+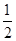 O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ/mol
O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ/mol
下列说法正确的是
| A.CH3OH的燃烧热为192.9 kJ/mol |
| B.反应①中的能量变化如上图所示 |
| C.CH3OH转变成H2的过程一定要吸收能量 |
D.根据②推知反应CH3OH(l)+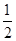 O2(g)===CO2(g)+2H2(g)的ΔH>-192.9 kJ/mol O2(g)===CO2(g)+2H2(g)的ΔH>-192.9 kJ/mol |
下列叙述正确的是 ( )
| A.原子晶体中可能存在离子键 | B.分子晶体中不可能存在氢键 |
| C.在晶体中可能只存在阳离子不存在阴离子 | D.金属晶体导电是金属离子所致 |
下列有关金属的叙述正确的是( )
| A.金属元素的原子具有还原性,其离子只有氧化性 |
| B.金属元素的化合价—般表现为正价 |
| C.熔化状态能导电的物质—定是金属的化合物 |
| D.金属元素的单质在常温下均为金属晶体 |
金属的下列性质中,与自由电子无关的是 ( )
| A.密度大小 | B.容易导电 | C.延展性好 | D.易导热 |
关于金属元素的特征,下列叙述正确的是( )
①金属元素的原子只有还原性,离子只有氧化性 ②金属元素在化合物中一般显正价 ③金属性越强的元素相应的离子氧化性越弱 ④金属元素只有金属性,没有非金属性 ⑤价电子越多的金属原子的金属性越强
| A.①②③ | B.②③ | C.①⑤ | D.全部 |
金属晶体的形成是因为晶体中存在( )
| A.金属离子间的相互作用 | B.金属原子间产生相互作用 |
| C.金属离子与自由电子间的相互作用 | D.金属原子与自由电子间的相互作用 |