次磷酸(H3PO2)是一种精细磷化工产品,具有较强的还原性。回答下列问题:
(1)H3PO2是一元中强酸,写出其电离方程式_______________________。
(2)H3PO2和NaH2PO2均可将溶液中的Ag+还原为Ag,从而可用于化学镀银。
①H3PO2中,P元素的化合价为__________;
②利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4:1,则氧化产物为___________(填化学式);
③NaH2PO2为___________(填“正盐”或“酸式盐”),其溶液显___ ____(填“弱酸性”、“中性”或“弱碱性”)。
(3)H3PO2的工业制法是:将白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,后者再与H2SO4反应,写出白磷与Ba(OH)2溶液反应的化学方程式______________________。
(4)H3PO2也可用电渗析法制备。“四室电渗析法”工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):
①写出阳极的电极反应式_________________ ___________________;
②分析产品室可得到H3PO2的原因__________________ _________________;
③早期采用“三室电渗析法”制备H3PO2:将“四室电渗析法”中阳极室的稀硫酸用H3PO2稀溶液代替,并撤去阳极室与产品室之间的阳膜,从而合并了阳极室与产品室。其缺点是产品中混有 杂质,该杂质产生的原因是 。
目前世界上60%的镁是从海水提取的。海水提镁的主要流程如下: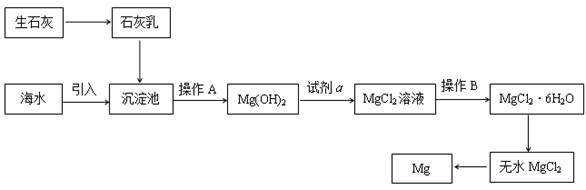
请回答下列问题:
(1)从离子反应的角度思考,在海水中加入石灰乳的作用是 ,写出在沉淀池的离子方程式 。
(2)石灰乳是生石灰与水形成的化合物,从充分利用海洋化学资源,提高经济效益的角度,生产生石灰的主要原料来源于海洋中的 。
(3)操作A是 , 操作B是 。
(4)加入的足量试剂a是 (填化学式)。
(5)无水MgCl2在熔融状态下,通电后会产生Mg和Cl2,该反应的化学方程式为
。从考虑成本和废物循环利用的角度,副产物氯气可以用于 。
(6)海水提镁的过程,为什么要将海水中的氯化镁转变为氢氧化镁,再转变为氯化镁?
。
(7)有同学认为:可直接加热Mg(OH)2得到MgO,再电解熔融MgO制金属镁,这样可简化实验步骤,体现实验的简约性原则。你 (填“同意”或“不同意”)该同学的想法,理由是 。
已知A是一种分子量为28的气态烃,能发生以下转化: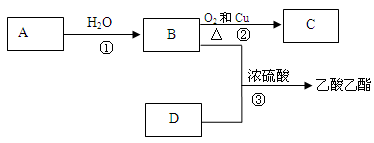
(1)写出B、D化合物中官能团:
B中含官能团(写名称);
D中含官能团(写结构简式);
(2)写出反应的化学方程式
①反应类型:
② 反应类型:
③ 反应类型:_________
下面列出了几组物质,请将物质的合适组号填写在空格上。
同位素,同素异形体,同分异构体,同系物。
①金刚石与“足球烯”C60; ②氧气(O2)与臭氧(O3); ③16O、17O和18O;
④ D与T ; ⑤乙醇(CH3CH2OH)和甲醚(CH3OCH3);
⑥CH4和CH3CH2CH3;
⑦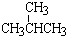 和
和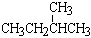 ; ⑧
; ⑧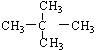 和
和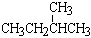 ;
;
⑨
已知:当羟基与双键碳原子相连时,易发生如下转化:
化学式为C9H10O2的有机物A有如下的转化关系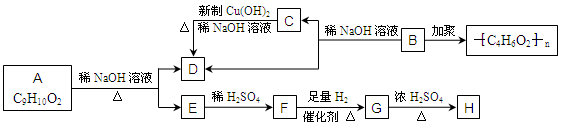
其中F与FeCl3溶液能发生显色反应,在G→H的反应中,有机物H只有一种结构且能使溴水褪色。试回答下列问题:
(1)写出有机物的结构简式:F、H、B。(2)写出A→E+D的化学方程式:。
(3)写出C→D的化学方程式:。
某强酸性溶液X含有Ba2+、Al3+、NH4+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、NO3-中的一种或几种,取该溶液进行连续实验,实验内容如下: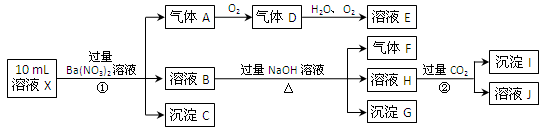
根据以上信息,回答下列问题:
(1)上述离子中,溶液X中除H+外还肯定含有的离是,不能确定是否含有的离子(Q)是,若要确定该Q(若不止一种,可任选一种)不存在,最可靠的化学方法是。
(2)沉淀G的化学式为。
(3)写出有关离子方程式:①中生成A。
②。
(4)假设测定A、F、I均为0.01mol,10mL X溶液中n(H+)=0.04mol,当沉淀C物质的量(填“<”、“=”或“>”某个值),表明Q离子一定是。(若不止一种可能,填对一种情况即可)