氮族元素包括氮(N)、磷(P)、砷(As)、锑(Sb)、铋(Bi)。
(1)氮是地球上含量丰富的一种元素,工业上用N2和H2合成NH3。
①已知:(Ⅰ)N2(g)+3H2(g)==2NH3(g) ∆H=-92.2KJ/mol (Ⅱ) N2(g)+O2(g)==2NO(g) ∆H=+180KJ/mol
(Ⅲ)H2(g)+1/2O2(g)==H2O(l) ∆H=—285.8KJ/mol,则4NH3(g)+5O2(g)==4NO(g)+6H2O(l) ∆H=________
②现将1 mol N2(g)、3mol H2(g)充入一容积为2L的密闭容器中,在500℃下进行反应,10 min时达到平衡,下列说法中正确的是 。
A.图甲是用H2表示的反应速率变化曲线
B.图乙表示反应过程中,混合气体平均相对分子质量为M,混合气体密度为d,混合气体压强为p的变化情况
C.图丙的两个容器中分别发生反应:N2(g)+3H2(g)==2NH3(g)、2NH3(g) ==N2(g)+3H2(g)。达到化学平衡时,相同组分的浓度相等且两个反应的平衡常数互为倒数
(2)反应PCl5(g)=PCl3(g)+Cl2(g) ∆H>0,在2L密闭容器中放人1molPCl5,保持一段时间后达到平衡。反应过程中测定的部分数据见下表:
①若改变温度使v(逆)增大,平衡____移动(填“正向”、“逆向”或“不”);
②T时,该反应的平衡常数为 。
(3)①推断As元素在周期表中的位置是 。
②已知某砷酸盐可发生如下反应:AsO43-+2I-+2H+=AsO33-+I2+H2O。某化学兴趣小组利用该反应原理设计如图所示装置:
C1、C2是石墨电极,A中盛有KI和I2混合溶液,B中盛有Na3AsO4和Na3AsO3的混合溶液,当连接开关K后,A中溶液颜色逐渐变深,灵敏电流计G的指针向右偏转。此时C2上发生的电极反应式是 ;一段时间后,当电流计指针回到中间“0”位时,再向B中滴加过量浓NaOH溶液,可观察到电流计指针 (填“不动”、“向左偏”或“向右偏”)。
元素X、Y、Z、M、N为短周期主族元素,且原子序数依次增大,已知Y原子最外层电子数与核外电子总数之比为3:4,M原子的最外层电子数与次外层电子数之比为3:4且M原子的质子数是Y原子的2倍,N-、Z+、X+的半径逐渐减小,化合物XN在常温下为气体,据此回答下列问题:
(1)写出Z与N形成的化合物的化学式_____。
(2)X与Y可分别形成10电子和18电子的分子,写出该18电子电子转化成10电子分子的化学方程式____(分解反应)。
(3)下图表示由上述元素组成的两种气体分子在一定条件下的密闭容器中充分反应前后的转化关系,请写出该转化过程的化学方程式:________。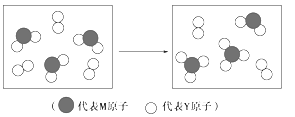
(4)A、B均为由上述五种元素中的三种元素组成的强电解质,且组成元素的原子个数之比为1:1:1。若在各自的水溶液中,A能抑制水的电离,B能促进水的电离,则A的化学式为____,B的化学式为_______。
【化学——选修5:有机化学基础】龙葵醛( )是一种珍贵的香料,广泛应用于香料、医药、染料及农药等行业。以下是以苯为原料生成龙葵醛的一种合成路线(部分反应条件及副产物已略去):
)是一种珍贵的香料,广泛应用于香料、医药、染料及农药等行业。以下是以苯为原料生成龙葵醛的一种合成路线(部分反应条件及副产物已略去):
(1)龙葵醛的分子式为 ,其中含氧官能团的名称是 ;
(2)A物质得到的1H-NMR谱中有 个吸收峰,B的结构简式可能为 。
(3)反应③的反应类型为 ,反应⑤的反应条件为 。
(4)反应⑥的化学方程式为 。
(5)龙葵醛具有多种同分异构体,其中某些物质有下列特征:a.其水溶液遇FeCl3溶液呈紫色;b.苯环上的一溴代物有两种;c.分子中没有甲基。写出符合上述条件的物质可能的结构简式(只写两种):
【化学——选修3:物质结构与性质】目前半导体生产展开了一场“铜芯片”革命——在硅芯片上用铜代替铝布线,古老的金属铜在现代科技应用上取得了突破,用黄铜矿(主要成分为CuFeS2)生产粗铜,其反应原理如下:
(1)基态铜原子的外围电子排布式为__________,硫、氧元素相比,第一电离能较大的元素是________(填元素符号)。
(2)反应①、②中均生成有相同的气体分子,该分子的中心原子杂化类型是________,其立体结构是_______。
(3)某学生用硫酸铜溶液与氨水做了一组实验:CuSO4溶液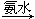 蓝色沉淀
蓝色沉淀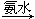 沉淀溶解,得到深蓝色透明溶液。写出蓝色沉淀溶于氨水的离子方程式_____________;深蓝色透明溶液中的阳离子(不考虑H+)内存在的全部化学键类型有 。
沉淀溶解,得到深蓝色透明溶液。写出蓝色沉淀溶于氨水的离子方程式_____________;深蓝色透明溶液中的阳离子(不考虑H+)内存在的全部化学键类型有 。
(4)铜是第四周期最重要的过渡元素之一,其单质及化合物具有广泛用途,铜晶体中铜原子堆积模型为_____________;铜的某种氧化物晶胞结构如图所示,若该晶体的密度为d g/cm3,阿伏加德罗常数的值为NA,则该晶胞中铜原子与氧原子之间的距离为________pm。((用含d和NA的式子表示)。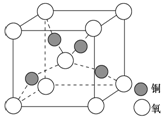
【化学-选修2:化学与技术】印尼火山喷发不仅带来壮观的美景,还给附近的居民带来物质财富,有许多居民冒着生命危险在底部的火山口收集纯硫磺块来赚取丰厚收入。硫磺可用于生产化工原料硫酸。某工厂用如图所示的工艺流程生产硫酸:
请回答下列问题:
(1)为充分利用反应放出的热量,接触室中应安装 (填设备名称),吸收塔中填充有许多瓷管,其作用是 .
(2)为使硫磺充分燃烧,经流量计1通入燃烧室的氧气过量50%,为提高SO2转化率,经流量计2的氧气量为接触室中二氧化硫完全氧化时理论需氧量的2.5倍,则生产过程中流经流量计1和流量计2的空气体积比应为 .假设接触室中SO2的转化率为95%,b管排出的尾气中二氧化硫的体积分数为 (空气中氧气的体积分数按0.2计),该尾气的处理方法是 .
(3)与以硫铁矿为原料的生产工艺相比,该工艺的特点是 (可多选).
A.耗氧量减少B.二氧化硫的转化率提高
C.产生的废渣减少 D.不需要使用催化剂
(4)硫酸的用途非常广,可应用于下列哪些方面 .
A.橡胶的硫化 B.表面活性剂“烷基苯磺酸钠”的合成
C.铅蓄电池的生产D.过磷酸钙的制备
(5)矿物燃料的燃烧是产生大气中SO2的主要原因之一.在燃煤中加入适量的石灰石,可有效减少煤燃烧时SO2的排放,请写出此脱硫过程中反应的化学方程式 .
七水硫酸镁(MgSO4•7H2O)在印染、造纸和医药等工业上都有广泛的应用,利用化工厂生产硼砂的废渣﹣硼镁泥可制取七水硫酸镁。硼镁泥的主要成分是MgCO3,还含有其他杂质(MgO、SiO2、Fe2O3、FeO、CaO、Al2O3、MnO等).
表1部分阳离子以氢氧化物形式完全沉淀时溶液的pH
| 沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Mn(OH)2 |
Mg(OH)2 |
| pH值 |
5.2 |
3.2 |
9.7 |
10.4 |
11.2 |
表2两种盐的溶解度(单位为g/100g水)
| 温度/℃ |
10 |
30 |
40 |
50 |
60 |
| CaSO4 |
0.19 |
0.21 |
0.21 |
0.20 |
0.19 |
| MgSO4•7H2O |
30.9 |
35.5 |
40.8 |
45.6 |
/ |
硼镁泥制取七水硫酸镁的工艺流程如下:
根据以上流程图并参考表格pH数据和溶解度数据,试回答下列问题:
(1)过滤I的滤液中加入硼镁泥,调节溶液的pH=5~6,再加入NaClO溶液加热煮沸,将溶液中的Mn2+氧化成MnO2,反应的离子反应方程式为 .加热煮沸的主要目的是 .
(2)沉淀B中除MnO2、SiO2外还含有 (填化学式)等物质.
(3)检验过滤Ⅱ后的滤液中是否含有Fe3+的实验方法是 ;
(4)沉淀C的化学式是 .过滤Ⅲ需趁热过滤的理由是 .