在2L密闭容器内,800℃时反应:2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
| 时间(s) |
0 |
1 |
2 |
3 |
4 |
5 |
| n(NO)(mol) |
2.0 |
1.0 |
0.8 |
0.7 |
0.7 |
0.7 |

(1)已知升高温度,NO2的浓度减小,则该反应是 热反应。
(2)下图中表示NO2的变化的曲线是 用O2表示从0~2 s内该反应的平均速率v = 
(3)为使该反应的反应速率增大,且平衡向正反应方向移动的是
a.及时分离除NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
含苯酚的工业废水的方案如下图所示:
回答下列问题:
(1)设备①进行的是操作(填写操作名称),实验室这一步操作所用的仪器是。
(2)由设备②进入设备③的物质A是,由设备③进入设备④的物质B是。
(3)在设备③中发生反应的化学方程式为。
(4)在设备④中,物质B的水溶液和CaO反应,产物是、和水,再通过过滤得产物。
(5)上图中,能循环使用的物质是C6H6、CaO、、。
(6)写出同时满足下列条件的苯酚的一种同分异构体的结构简式是。
①核磁共振氢谱只有一个峰②分子中无碳碳双键
在有机物分子中,不同氢原子的核磁共振谱中给出的信号也不同,根据信号可以确定有机物分子中氢原子的种类和数目。例如二乙醚的结构简式为: CH3—CH2—O—CH2—CH3,其核磁共振谱中给出的信号有两个,如图①所示:
(1)下列物质中,其核磁共振氢谱中给出的信号只有一个的是。(填序号)
| A.CH3CH3 | B.CH3COOH | C. CH3OH | D. CH3OCH3 |
(2)化合物A和B的分子式都是C2H4Br2, A的核磁共振氢谱图如右图②所示,则A的结构简式为,请预测B的核磁共振氢谱上有种信号。
(3)在常温下测得的某烃C8H10(不能与溴水反应)的核磁共振谱上,观察到两种类型的H原子给出的信号,其强度之比为2:3,试确定该烃的结构简式为;该烃在光照下生成的一氯代物在核磁共振谱中可产生种信号,强度比为。
(4)在常温下测定相对分子质量为128的某链烃的核磁共振谱,观察到两种类型的H原子给出的信号,其强度之比为9:1,则该烃的结构简式为,其名称为。
药物Z可用于治疗哮喘、系统性红斑狼疮等,可由X(咖啡酸)和Y(1,4-环己二酮单乙二醇缩酮)为原料合成(如下图)。
试填空:
(1)X的分子式为;该分子中最多共面的碳原子数为。
(2)Y中含有个手性碳原子。
(3)Z能发生反应。(填序号)
A.取代反应 B.消去反应C.加成反应 D.催化氧化反应
(4)鉴别X和Z可用下列何种物质?
A.Br2水B.酸性KMnO4溶液C.FeCl3溶液 D.Na2CO3溶液
(5)1 mol Z与足量的氢氧化钠溶液充分反应,需要消耗氢氧化钠mol;
1 mol Z在一定条件下与足量Br2充分反应,需要消耗Br2 mol。
1 mol Z在一定条件下与足量H2充分反应,需要消耗H2 mol。
按要求填空:
(1)某有机物的结构简式为: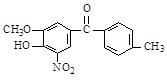 ,该有机物中含氧官能团有:、、、(写官能团名称)。
,该有机物中含氧官能团有:、、、(写官能团名称)。
(2)有机物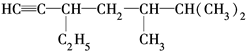 的系统名称是,将其在催化剂存在下完全氢化,所得烷烃的系统名称是。
的系统名称是,将其在催化剂存在下完全氢化,所得烷烃的系统名称是。
(3)下图是某一有机物的红外光谱图,该有机物的相对分子质量为74,则其结构简式为。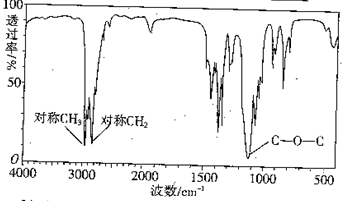
(4)苯的同系物中,有的侧链能被酸性高锰酸钾溶液氧化,生成芳香酸,反应如下: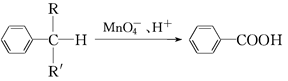
(R、R′表示烷基或氢原子)
①现有苯的同系物甲和乙,分子式都是C10H14。甲不能被酸性高锰酸钾溶液氧化为芳香酸,它的结构简式是;乙能被酸性高锰酸钾溶液氧化为分子式为C8H6O4的芳香酸,则乙可能的结构有种。
②有机物丙也是苯的同系物,分子式也是C10H14,它的苯环上的一溴代物只有一种。丙的结构简式共有四种,写出其余三种: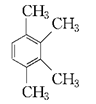 、、、。
、、、。
(5)已知:RCH=CHR,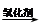 RCOOH+R,COOH。写出
RCOOH+R,COOH。写出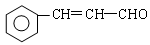 在强氧化剂条件下生成
在强氧化剂条件下生成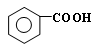 和另一种有机物(写出其结构简式)。
和另一种有机物(写出其结构简式)。
铜既能与稀硝酸反应,也能与浓硝酸反应,当铜与一定浓度硝酸反应时,可将方程式表示为:Cu+HNO3→Cu(NO3)2+NO↑+NO2↑+H2O (方程式未配平)
(1)硝酸在该反应中表现出的性质是_____,该反应的还原产物是_____。
(2)0.4molCu被硝酸完全溶解后,硝酸得到的电子数是_____,如果得到的NO和NO2物质的量相同,则参加反应的硝酸的物质的量是_____mol。
(3)0.3molCu被另一浓度的硝酸完全溶解后,如果此时产生的NO和NO2气体总体积在标准状况下为8.96 L,则被还原的硝酸的物质的量是_____ mol,参加反应的硝酸的物质的量是_____mol,产生的混合气体中NO和NO2体积比为_______。