(16分)I.合成氨的原料气H2可通过反应CO(g)+H2O(g)  CO2 (g) +H2(g) 获取。
CO2 (g) +H2(g) 获取。
(1)T ℃时,向容积固定为5 L的容器中充入1 mol水蒸气和1 mol CO,反应达平衡后,测得CO的浓度为0.08 mol·L-1,则平衡时CO的转化率为 ,该温度下反应的平衡常数K值为 。
(2)保持温度仍为T ℃,改变水蒸气和CO的初始物质的量之比,充入固定容器中进行反应,下列描述能够说明体系处于平衡状态的是 (填序号)。
a.容器内压强不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成a mol CO2的同时消耗a mol H2
d.混合气中n (CO) : n (H2O) : n (CO2) : n (H2) = 1 : 16 : 6 : 6
II.(1)液氨作为一种潜在的清洁汽车燃料已越来越被研究人员重视。它在安全性、价格等方面较化石燃料和氢燃料有着较大的优势。氨在燃烧实验中相关的反应有:
①4NH3(g)+3O2(g)=2N2(g)+6H2O(l) △H1
②4NH3(g)+5O2(g)=4NO(g)+6H2O(l) △H2
③4NH3(g)+6NO(g)=5N2(g)+6H2O(l) △H3
请写出上述三个反应中△H1、△H2、△H3三者之间关系的表达式,△H1= 。
(2)美国Simons等科学家发明了使NH3直接用于燃料电池的方法,其装置用铂作为电极、加入碱性电解质溶液,其电池反应为4NH3+3O2=2N2+6H2O
①写出该燃料电池的正极反应式 。
②若用该燃料电池产生的电能在铁皮上镀锌(制白铁皮),某铁皮上现需要镀上9.75g锌,理论上至少需要消耗标准状况的氨气 L。
III.(1)下图是金属镁和卤素反应的能量变化图(反应物和产物均为298K时的稳定状态)。由图可知Mg与卤素单质的反应均为 (填“放热”或“吸热”)反应。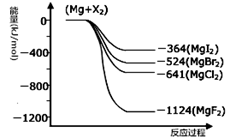
(2)金属Mg与CH3Cl在一定条件下反应可生成CH3MgCl,CH3MgCl是一种重要的有机合成试剂,易与水发生水解反应并有无色无味气体和沉淀生成。写出CH3MgCl水解的化学方程式 。
向等体积pH=a的盐酸和pH=b的醋酸溶液中分别加入100 mL pH=12的NaOH溶液,充分反应后,两溶液均呈中性。则:
(1)a与b的关系为a________b(填“大于”、“小于”或“等于”,下同)。
(2)向等体积的该盐酸和醋酸溶液中分别加入足量的锌粉,充分反应后,产生H2的体积关系为V(H2)盐酸________V(H2)醋酸;反应完成所需时间t(HCl)________t(CH3COOH)。
(3)若盐酸的体积为10 mL,则盐酸的物质的量浓度为__________________。
氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节能30%以上。在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出: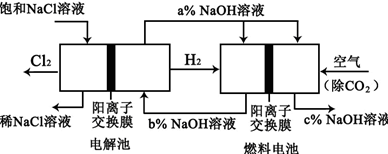
回答下列有关问题:
(1)电解池的阴极反应式为___________________________。
(2)通入空气的电极的电极反应式为___________________________,燃料电池中阳离子的移动方向_________________________(“从左向右”或“从右向左”)。
(3)电解池中产生2 mol Cl2,理论上燃料电池中消耗O2的物质的量为_____________。
(4)a、b、c的大小关系为:_____________。
煤化工中常需研究不同温度下平衡常数、投料比及产率等问题。
已知:CO(g) + H2O(g)  CO2(g) + H2(g)的平衡常数随温度的变化如下表:
CO2(g) + H2(g)的平衡常数随温度的变化如下表:
| 温度/℃ |
400 |
500 |
830 |
1000 |
| 平衡常数K |
10 |
9 |
1 |
0.6 |
试回答下列问题
(1)上述反应的正反应是反应(填“放热”或“吸热”)。
(2)某温度下,上述反应达到平衡后,保持容器体积不变升高温度,正反应速率_______(填“增大”、“减小”或“不变”),容器内混合气体的压强_____________(填“增大”、“减小”或“不变”)。
(3)830℃时,在恒容反应器中发生上述反应,按下表中的物质的量投入反应混合物,其中向正反应方向进行的有(选填A、B、C、D)。
| A |
B |
C |
D |
|
| n(CO) |
1 |
2 |
3 |
0.5 |
| n(H2O) |
5 |
2 |
3 |
2 |
| n(CO2) |
3 |
1 |
0 |
1 |
| n(H2) |
2 |
1 |
0 |
1 |
(4)830℃时,在2 L的密闭容器中加入4 mol CO(g)和6 mol H2O(g)达到平衡时,CO的转化率是。
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(图中的△H表示生成1 mol产物的数据)。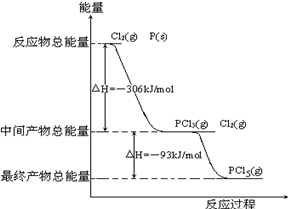
根据上图回答下列问题:
(1)PCl3分解成P(s)和Cl2(g)的热化学方程式是__________________________________。
(2)P和Cl2分两步反应生成1 mol PCl5的△H1=_______________,与P和Cl2一步反应生成1 mol PCl5的△H2的关系是:△H2__________△H1(填“大于”、“小于”或“等于”)。
(1)某温度下,纯水中c(H+) = 5×10-7 mol·L-1,则此时纯水中的c(OH-)=" ____" mol·L-1;若温度不变,滴入稀硫酸使c(H+) = 5.0×10-3 mol·L-1,则c(OH-)=" ____" mol·L-1。
(2)已知室温下pH=2的高碘酸(H5IO6)溶液与pH=12的NaOH溶液等体积混合,所得混合溶液呈酸性,则高碘酸的电离方程式是__________________________。