(16分)污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题。某研究小组利用软锰矿(主要成分为MnO2,另含有少量铁、铝、铜、镍等金属化合物)作脱硫剂,通过如下简化流程既脱除燃煤尾气中的SO2,又制得电池材料MnO2(反应条件已省略)。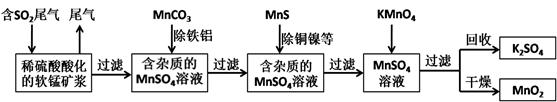
请回答下列问题:
(1)上述流程中多次涉及到过滤操作,实验室进行过滤操作时需要用到的硅酸盐仪器有玻璃棒、 、 ;其中玻璃棒的作用是 。
(2)用MnCO3能除去溶液中的Al3+和Fe3+,其原理是 。
(3)已知Ksp(CuS)=8.4×10-45,Ksp(NiS)=1.4×10-24;在除铜镍的过程中,当Ni2+恰好完全沉淀 (此时溶液中c(Ni2+)=1.0×10-5mol/L),溶液中Cu2+的浓度是 mol/L。
(4)工业上采用电解K2MnO4水溶液的方法来生产KMnO4,其中隋性电极作阳极,铁作阴极,请写出阳极的电极反应式 。
(5)下列各组试剂中,能准确测定一定体积燃煤尾气中SO2含量的是__________。(填编号)
a.NaOH溶液、酚酞试液
b.稀H2SO4酸化的KMnO4溶液
c.碘水、淀粉溶液
d.氨水、酚酞试液
(6)除杂后得到的MnSO4溶液可以通过 (填操作名称)制得硫酸锰晶体(MnSO4•H2O,相对分子质量为169)。已知废气中SO2浓度为8.4 g/m3,软锰矿浆对SO2的吸收率可达90%,则处理1000 m3燃煤尾气,可得到硫酸锰晶体质量为 kg(结果保留3位有效数字)。
请回答下列问题:
(1)
、
、
、
四种元素中,有一种元素的电离能数据如下:
| 电离能 … |
| 5781817274511578… |
(2)则该元素是(填写元素符号)。
原子的电子排布式是。
的最高价氯化物分子式是。该元素可能的性质或应用有。
A.是一种活泼的金属元素
B.其电负性大于硫
C.其单质可作为半导体材料
D.其最高价氯化物的沸点低于其溴化物的沸点
关于化合物 ,下列叙述正确的有。
,下列叙述正确的有。
A.分子间可形成氢键
B.分子中既有极性键又有非极性键
C.分子中有7个
键和1个
键
D.该分子在水中的溶解度大于2-丁烯
(4)
的熔点 的熔点(填>、<或=),其原因是
的熔点(填>、<或=),其原因是
捕碳技术(主要指捕获
)在降低温室气体排放中具有重要的作用。
目前
和
已经被用作工业捕碳剂,它们与
可发生如下可逆反应:
反应Ⅰ:2
+
+

反应Ⅱ:
+
+

反应Ⅲ:
+
+
 2
2
请回答下列问题:
(1)
与
、
之间的关系是:
。
(2)为研究温度对
捕获
效率的影响,在某温度T1下,将一定量的
溶液置于密闭容器中,并充入一定量的
气体(用氮气作为稀释剂),在
时刻,测得容器中
气体的浓度。然后分别在温度为
、
、
、
下,保持其它初始实验条件不变,重复上述实验,经过相同时间测得
气体浓度,得到趋势图(见图1)。则:
①
0(填>、=或<)。
②在
~
及
~
二个温度区间,容器内
气体浓度呈现如图1所示的变化趋势,其原因是。
③反应Ⅲ在温度为
时,溶液
随时间变化的趋势曲线如图2所示。当时间到达
时,将该反应体系温度上升到
,并维持该温度。请在图中画出
时刻后溶液的
变化总趋势曲线。()
(3)利用反应Ⅲ捕获
,在
初始浓度和体积确定的情况下,提高
吸收量的措施有(写出2个)。
(4)下列物质中也可能作为
捕获剂的是。
| A. | . | B. | . |
| C. | . | D. |
.
|
氢能源是一种重要的清洁能源。现有两种可产生
的化合物甲和乙。将6.00
甲加热至完全分解,只得到一种短周期元素的金属单质和6.72
(已折算成标准状况)。甲与水反应也能产生
,同时还产生一种白色沉淀物,该白色沉淀可溶于
溶液。化合物乙在催化剂存在下可分解得到
和另一种单质气体丙,丙在标准状态下的密度为1.25
。请回答下列问题:
(1)甲的化学式是;乙的电子式是。
(2)甲与水反应的化学方程式是。
(3)气体丙与金属镁反应的产物是(用化学式表示)。
(4)乙在加热条件下与
反应可生成
和气体丙,写出该反应的化学方程式。
有人提出产物
中可能还含有,请设计实验方案验证之。
(已知
)
(5)甲与乙之间(填"可能"或"不可能)发生反应产生
,判断理由是。
化合物Ⅰ(
)是制备液晶材料的中间体之一,其分子中含有醛基和酯基。Ⅰ可以用
和
在一定条件下合成:
已知以下信息:
的核磁共振氢谱表明其只有一种化学环境的氢;
 化合物
苯环上的一氯代物只有两种;
化合物
苯环上的一氯代物只有两种;
通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基。
回答下列问题:
(1)
的化学名称为。
(2)
的结构简式为。
(3)
的分子式为。
(4)
生成
的化学方程式为,该反应类型为。
(5)
的结构简式为。
(6)
的同系物
比
相对分子质量小14,
的同分异构体中能同时满足如下条件:
①苯环上只有两个取代基,②既能发生银镜反应,又能和饱和
溶液反应放出
,共有种(不考虑立体异构)。
的一个同分异构体发生银镜反应并酸化后核磁共振氢谱为三组峰,且峰面积比为2:2:1,写出
的这种同分异构体的结构简式。
前四周期原子序数依次增大的元素
,
,
,
中,
和
的价电子层中未成对电子均只有1个,平且
和
的电子相差为8;与
位于同一周期的
和
,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2。
回答下列问题:
(1)
的价层电子排布图为。
(2)四种元素中第一电离最小的是,电负性最大的是。(填元素符号)
(3)
、
和
三种元素责成的一个化合物的晶胞如图所示。
①该化合物的化学式为;
的配位数为;
②列式计算该晶体的密度
。
(4)
、
和
三种离子组成的化合物
,其中化学键的类型有;该化合物中存在一个复杂离子,该离子的化学式为,配位体是。