(Ⅰ)下列A、B、C、D是中学常见的混合物分离或提纯的基本装置。
请根据混合物分离或提纯的原理,回答在下列实验中需要使用哪种装置。将A、B、C、D填入适当的空格中。
①.除去NaOH溶液中悬浮的CaCO3 ;②.从溴水中提取溴 ;
③.用自来水制取蒸馏水 ;④.与海水晒盐原理相符的是 。
(Ⅱ)某化学课外小组以海带为原料制取少量碘水,现用CCl4从碘水中萃取碘并用分液漏斗分离两种溶液。其实验可分解为如下各步:
A.把盛有溶液的分液漏斗放在铁架台的铁圈中;
B.把50mL碘水和15mL CCl4加入分液漏斗中,并盖好玻璃塞;
C.检验分液漏斗活塞和上口的玻璃塞是否漏液;
D.倒转漏斗振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
E.旋开活塞,用烧杯接收溶液;
F.从分液漏斗上口倒出上层水溶液;
G.将分液漏斗上口的玻璃塞打开或使塞上的凹槽或小孔对准分液漏斗上口的小孔;
H.静置、分层。
就此实验完成下列填空:
(1)正确操作步骤的顺序是(用上述各操作的编号字母填写):
________→________→________→A→________→G→E→F。
(2)上述G步骤操作的目的是_________________________________________________。
有机物A广泛用于涂料、油墨、胶黏剂、医药及农药中间体领域。
已知:有机物A的仪器分析如下:
①有机物A的质谱
②有机物A的红外光谱
③有机物A的核磁共振氢谱图上有2个吸收峰,峰面积之比是1:1。
回答下列问题:
(1)A的相对分子质量是____________;
(2)A含有官能团的名称是____________;
(3)A与氢氧化钠溶液在加热条件下反应的化学方程式是______________________;
(4)A有多种同分异构体,其中能与新制Cu(OH) 2共热,产生红色沉淀的有____________种,写出其中任意一种同分异构体的结构简式________________________。
有机物F(C9H10O2)是一种有茉莉花香味的酯。用下图所示的方法可以合成F。其中A是相对分子质量为28的烃,其产量常作为衡量石油化工发展水平的标志。E是只含碳、氢、氧的芳香族化合物,且苯环上只有一个侧链。
回答下列问题:
(1)A的分子式是____________;
(2)B的结构简式是________________________;
(3)为检验C中的官能团,可选用的试剂是____________;
(4)反应④的化学方程式是__________________。
Ⅰ.实验室制得气体中常含有杂质,影响其性质检验。下图A为除杂装置,B为性质检验装置,完成下列表格: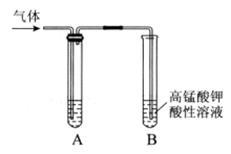
| 序号 |
气体 |
反应原理 |
A中试剂 |
| ① |
乙烯 |
溴乙烷和NaOH的醇溶液加热 |
|
| ② |
乙烯 |
无水乙醇在浓硫酸的作用下加热至170℃反应的化学方程式是。 |
NaOH溶液 |
| ③ |
乙炔 |
电石与饱和食盐水反应 |
Ⅱ.为探究乙酸乙酯的水解情况,某同学取大小相同的3支试管,分别加入以下溶液,充分振荡,放在同一水浴加热相同时间,观察到如下现象。
| 试管编号 |
① |
② |
③ |
| 实验操作 |
 |
 |
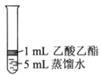 |
| 实验现象 |
酯层变薄 |
酯层消失 |
酯层基本不变 |
(1)试管①中反应的化学方程式是________________;
(2)对比试管①和试管③的实验现象,稀H2SO4的作用是________________;
(3)试用化学平衡移动原理解释试管②中酯层消失的原因。
A~G是几种烃的分子球棍模型(如图),据此回答下列问题: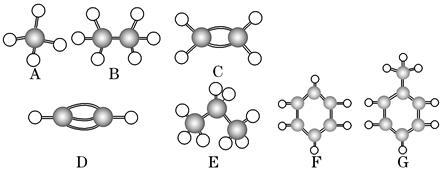
(1)常温下含碳量最高的气态烃是________(填字母)。
(2)不能够发生加成的烃有________种。
(3)一卤代物有两种的是________(填字母)。
(4)等质量的上述烃燃烧耗氧最多的是________(填字母)。
(5)写出实验室制C的化学方程式_______________。
(6)写出F发生溴代反应的化学方程式____________。
某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用下图所示装置进行了有关实验:
(1)B是用来收集实验中产生的气体的装置,但未将导管画全,请直接在原图上把导管补充完整。
(2)实验中他们取6.4g铜片和12mL 18mol·L-1浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
①请写出铜跟浓硫酸反应的化学方程式: ②为什么有一定量的余酸但未能使铜片完全溶解,你认为原因是: 。
③下列药品中能够用来证明反应结束后的烧瓶中确有余酸的是:________(填写字母编号)。
A.铁粉 B.氯化钡溶液 C.银粉 D.碳酸氢钠溶液
(3)为定量测定余酸的物质的量浓度,某位同学进行了如下设计:先测定铜与浓硫酸反应产生SO2的量,再计算余酸的物质的量浓度。他认为测定SO2的量的方法有多种,请问下列实验方案中可行的是__________(填写字母编号)。其中计算结果余酸物质的量浓度比实际偏高的是_______________(填写字母编号)
A.将装置A产生的气体缓缓通过预先称量过的盛有碱石灰的干燥管,结束反应后再次称量
B.将装置A产生的气体缓缓通入足量用稀硫酸酸化的高锰酸钾溶液,再加入足量氯化钡溶液,过滤、洗涤、干燥、称量沉淀
C.用排水法测定装置A产生气体的体积(已折算成标准状况)
D.将装置A产生的气体缓缓通入足量氢氧化钡溶液,反应完全后,过滤、洗涤、干燥、称量沉淀
E.将装置A产生的气体缓缓通入足量硝酸酸化的硝酸钡溶液,反应完全后,过滤、洗涤、干燥、称量沉淀(已知:硝酸具有强氧化性)
若A项不可行,请写出改进的方法:___________________(若A项可行则该空写“不用改进”)