某无机化合物A由X、Y两种元素组成。在空气中充分灼烧得到含X元素的8g红棕色固体B,并产生能使品红褪色的气体C,将该气体全部通入足量的双氧水中得D溶液,再向D溶液中加入足量的BaCl2溶液,过滤、洗涤、干燥得46.6g固体。
(1)写出X在元素周期表中的位置 ,写出Y2-的结构示意图
写出B的化学式
(2)写出气体C通入H2O2中反应的离子方程式
(3)将A溶于D的稀溶液中得到E,并产生一种单质固体和一种气体,写出该反应的化学方程式
(4)将化合物E固体隔绝空气充分灼烧,使其分解,生成等物质的量的B、C和另一种化合物,则另一种化合物的分子式是 ;有同学认为该分解反应得到的固体产物中除B外,还可能会有含X元素的低价态物质,请判断该同学的观点是否合理 理由是
(5)请设计实验证明E完全分解后的固体产物中是否含有X元素的低价态化合物
(1)对反应N2O4(g) 2NO2(g) △H>0 ,在温度为T1、 T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。T1T2(填“>”、“<”或“=”);A、C两点的速率vA vC(
2NO2(g) △H>0 ,在温度为T1、 T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。T1T2(填“>”、“<”或“=”);A、C两点的速率vA vC( 同上)。
同上)。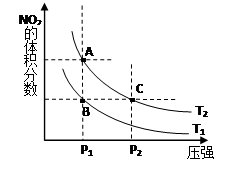
(2)在100℃时,将0.400mol的NO2气体充入2L真空定容密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
| 时间(s) |
0 |
20 |
40 |
60 |
80 |
| n(NO2)/mol |
0.40 |
n1 |
0.26 |
n3 |
n4 |
| n(N2O4)/mol |
0.00 |
0.05 |
n2 |
0.08 |
0.08 |
①在上述条件下,从反应开始直至20s时,二氧化氮的平均反应速率为;
②该反应的平衡常数K的值为;
③若在相同情况下最初向该容器充入的是N2O4,要达到上述同样的平衡状态,N2O4的起始浓度是mol/L。
④计算③中条件下达到平衡后混合气体的平均相对分子质量为;(结果保留小数点后一位)
固定和利用CO2能 有效地利用资源,并减少空气中的温室气体。CO2与化合物Ⅰ反应生成化合物Ⅱ,与化合物III反应生成化合物Ⅳ,如反应①和②所示(其他试剂、产物及反应条件均省略)。
有效地利用资源,并减少空气中的温室气体。CO2与化合物Ⅰ反应生成化合物Ⅱ,与化合物III反应生成化合物Ⅳ,如反应①和②所示(其他试剂、产物及反应条件均省略)。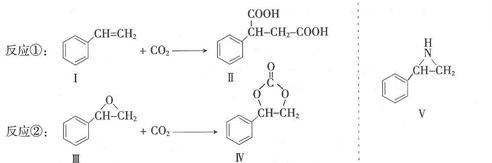
⑴化合物Ⅰ的分子式为 ,1 mol该物质完全燃烧需消耗 mol O2。
⑵由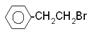 通过消去反应制备Ⅰ的化学方程式为 (注明反应条件)。
通过消去反应制备Ⅰ的化学方程式为 (注明反应条件)。
⑶Ⅱ与过量C2H5OH在酸催化下发生酯化反应,生成的有机物的结构简式为 .
⑷在一定条件下,化合物Ⅴ能与CO2发生类似反应②的反应,生成两种化合物(互为同分异构体),请写出其中任意一种化合物的结构简式: 。
⑸与CO2类似,CO也能被固定和利用,在一定条件下,CO、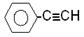 和H2三者发生反应(苯环不参与反应),生成化合物Ⅵ和Ⅶ,其分子式均为C9H8O,且都能发生银镜反应。下列关于Ⅵ和Ⅶ的说法正确的有 (双选,填字母).
和H2三者发生反应(苯环不参与反应),生成化合物Ⅵ和Ⅶ,其分子式均为C9H8O,且都能发生银镜反应。下列关于Ⅵ和Ⅶ的说法正确的有 (双选,填字母).
A都属于芳 香烃衍生物 B.都能使溴的四氯化碳溶液褪色
香烃衍生物 B.都能使溴的四氯化碳溶液褪色
C.都能与Na反应放出H2 D.1mol Ⅵ或Ⅶ最多能与4 mol H2发生加成反应
近年来,国际原油价格大幅上涨,促使各国政府加大生物能源生产,其中酒精汽油已进入实用化阶段。
(1)乙醇在铜或银作催化剂的条件下,可以被空气中的氧气氧化成X,X可发生银镜反应,请写出X被银氨溶液氧化的反应方程式(标出具体反应条件):。
(2)乙醇可以与酸性重铬酸钾溶液反应,被直接氧化成Y,Y 含有官能团的名称是______。在浓硫酸作用下,乙醇与Y反应可生成一种有香味的物质W,化学方程式为___________。
(3)现有两瓶无色液体,分别盛有Y、W,只用一种试剂就可以鉴别,该试剂可以是或。
(4)现代石油化工采用银作催化剂,乙烯能被氧气氧化生成环氧乙烷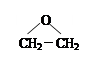 ,该
,该
反应的原子利用率为100%,反应的化学方程式为。
请写出以下反应的化学方程式或离子方程式
(1) 乙炔制聚氯乙烯的反应方程式
(2) 苯与氢气的加成反应
(3) 乙醇催化氧化生成乙醛的反应方程式
(4) 苯酚钠溶液通入二氧化碳的反应的离子方程式
(5) 用浓溴水鉴别苯和苯酚溶液发生的有关反应化学方程式
如下图所示的装置,C、D、E、F都是惰性电极。将电源接通后,向乙中滴入酚酞液,在F极附近显红色。试回答以下问题: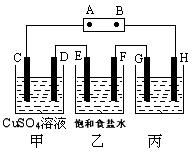
(1)电源的A极是_______;
(2)写出甲装置中电解反应的总方程式:_________;
(3)如果收集乙装置中产生的气体,EF两电极产生的气体的体积比是______________;
(4)欲用丙装置给铜镀银,G应该是_______,电镀液的主要成分是_________(填化学式)。