下列说法正确的是
| A.金属离子被还原一定生成金属单质 |
| B.向FeCl3溶液投入一定量的铁铜合金,反应结束后可能出现有铜无铁的情况 |
| C.氯气和二氧化硫通入水中都有漂白作用,如两者1:1混合通入水中后漂白能力更强 |
| D.硫酸钡是难溶盐,溶液导电能力很弱,因此属于弱电解质 |
化学用语是学习化学的重要工具,下列化学用语中正确的是
A.Na2S的水解:S2-+ 2H2O H2S + 2OH- H2S + 2OH- |
B.NaHCO3的电离:NaHCO3  Na + + H+ + CO32- Na + + H+ + CO32- |
C.HSO3-的电离:HSO3-  H+ + SO32- H+ + SO32- |
| D.钢铁的电化学腐蚀的负极反应式:Fe-3e-Fe3+ |
1905年德国化学家哈伯发明了合成氨的方法。他因此获得了1918年度诺贝尔化学奖。哈伯法合成氨需要在20—50 MPa的高压和500 ℃的高温下,用铁作催化剂,且氨转化率10%—15%。2005年6月27日美国化学会刊报道,美国俄勒冈大学的化学家使用了一种名为transFe(DMeOPrPE)2Cl2的铁化合物。用transFe(DMeOPrPE)2Cl2作催化剂,在常温常压下合成出氨,反应可表示为N2+3H2 2NH3,有关说法正确的是
2NH3,有关说法正确的是
| A.不同的催化剂对化学反应速率影响均相同 |
| B.新法合成与哈伯法相比不需要在高温条件下,可节约大量能源,极具发展远景 |
| C.新法合成能在常温下进行是因为不需要断裂化学键 |
| D.哈伯法合成氨是吸热反应,新法合成氨是放热反应 |
描述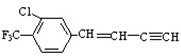 分子的下列叙述中,错误的是
分子的下列叙述中,错误的是
| A.与苯环直接相连的原子都在同一平面上 |
| B.分子中的碳原子分别采取sp、sp2、sp3杂化,分子中共有10个不饱和碳原子 |
| C.最多有18个原子可能处在同一个平面上 |
| D.分子式为C11H6ClF3 |
碳原子数为12且只有两个侧链的苯的同系物的同分异构体数目为
| A.42 | B.45 | C.48 | D.60 |
过氧乙酸(CH3COOOH)是一种高效消毒剂,具有很强的氧化性和腐蚀性,可以迅速杀灭多种微生物,包括多种病毒、细菌、真菌及芽孢。过氧乙酸可由冰醋酸与过氧化氢在一定条件下反应制得,下列有关过氧乙酸的叙述中正确的是
| A.过氧乙酸与羟基丙酸(HOCH2CH2COOH)组成上相差一个CH2,故互为同系物 |
| B.苯酚也能杀菌消毒,过氧乙酸与苯酚混合使用,可增强过氧乙酸的杀菌效果 |
| C.由下列过氧乙酸的制取原理可以看出,过氧乙酸属于酯类有机物CH3COOH + H2O2→CH3COOOH + H2O |
| D.过氧乙酸不仅能使蛋白质变性,同时还具有漂白性,其漂白原理与双氧水相同 |