甲醇是一种重要的化工原料和新型燃料。
Ⅰ.以CO2为碳源制取低碳有机物一直是化学领域的研究热点,CO2加氢制取低碳醇的反应如下:
反应I:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH=-49.0kJ/mol
反应II:2CO2(g)+6H2(g)=CH3CH2OH(g)+3H2O(g) ΔH=-173.6kJ/mol
写出由CH3OH(g)合成CH3CH2OH(g)的反应的热化学方程式 。
Ⅱ.工业上一般以CO和H2为原料在密闭容器中合成甲醇:
CO(g)+2H2(g) 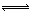 CH3OH(g) ΔH=-90.8 kJ·mol-1
CH3OH(g) ΔH=-90.8 kJ·mol-1
在容积为1 L的恒容容器中,分别研究在230 ℃、250 ℃和270 ℃三种温度下合成甲醇的规律。下图是上述三种温度下H2和CO的起始组成比(起始时CO的物质的量均为1 mol)与CO平衡转化率的关系,则曲线Z对应的温度是________;该温度下上述反应的化学平衡常数的表达式为 ;若增大H2的用量,上述反应的热效应最大值为____________kJ。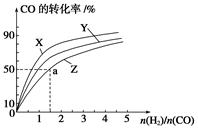
Ⅲ.下图是甲醇燃料电池工作的示意图,其中A、B、D均为石墨电极,C为铜电极。工作一段时间后,断开K,此时A、B两极上产生的气体体积相同。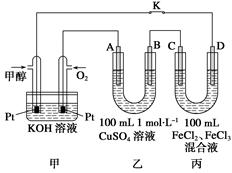
(1)甲中负极的电极反应式为________。
(2)乙中A极析出的气体在标准状况下的体积为________________。
(3)丙装置溶液中金属阳离子的物质的量与转移电子的物质的量变化关系如图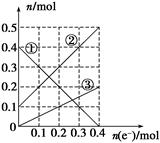
则图中②线表示的是________的变化;反应结束后,要使丙装置中金属阳离子恰好完全沉淀,需要________ mL 5.0 mol·L-1 NaOH溶液。
有A、B、C、D四种无色可溶性盐分别是由Na+、Mg2+、Ag+、Ba2+、Cl-、CO32-、HCO3-、NO3-中不同的阴阳离子所组成。A溶液与硫酸反应只有气体生成,B溶液与硫酸反应只有沉淀生成,C溶液与硫酸反应既有气体又有沉淀生成,D溶液与硫酸反应既无气体又无沉淀生成,则
(1)D为 ;(写化学式)
(2)分别写出下列反映的三个离子方程式
①A与足量的硫酸溶液 ;
②C与足量的硫酸溶液 ;
③C与少量的氢氧化钠溶液 。
Ⅰ.过氧化氢俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。回答下列有关双氧水的问题:
(1)下述反应中,H2O2仅体现氧化性的反应是(填代号) 。
A.Na2O2+2HCl=2NaCl+H2O2
B.Ag2O+H2O2=2Ag+O2↑+H2O
C.2H2O2=2H2O+O2↑
D.3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O
(2)保存过氧化氢的试剂瓶上最适合贴上的一个标签是 (填代号)。
A.自燃物品 B.氧化剂 C.剧毒品 D.腐蚀品
Ⅱ某实验小组为探究ClO-、I2、SO42-在酸性条件下的氧化性强弱,已知I2遇淀粉变蓝,设计实验如下:
实验①:在淀粉KI溶液中加入少量NaClO溶液,并加入少量的稀H2SO4,溶液立即变蓝;
实验②:向实验①的溶液中加入4 L 0.5 mol/L的Na2SO3溶液,发生反应如下
SO32-+ I2+H2O→SO42-+I-+H+(未配平),恰好完全反应。
(1)以上实验说明,在酸性条件下ClO-、I2、SO42-的氧化性由弱到强的顺序是 。
(2)实验②中化学反应转移电子的物质的量是 。
(3)写出实验①中发生反应的离子方式 。
(1)下图所示是中学化学常用的玻璃仪器,请在下列操作中填入相应的仪器名称
①从氯化钠溶液中获得氯化钠晶体______。
②分离CCl4(沸点为76.75℃)和甲苯(沸点为110.6℃)的混合物______。
(2)实验室需用230ml 1.0mol/L的NaOH溶液
①在配制溶液过程中,上述仪器中还缺少的玻璃仪器是:________玻璃捧等。
②计算需称量的NaOH固体质量为_______________g
③配制过程中,下列操作情况会使结果偏低的是
| A.溶解后未冷却直接转移至容量瓶,立即定容 |
| B.转移溶液后,未洗涤烧杯和玻璃棒就直接定容 |
| C.定容时,俯视容量瓶刻度线观察液面 |
| D.定容后,倒置容量瓶摇匀经平放静置,液面低于刻度线,继续加水定容 |
(3)若 1.0mol/LNaOH溶液的密度为1.1g/cm3,则质量分数为__________%
现有下列物质:
①干冰 ②NaHCO3晶体 ③氨水 ④纯醋酸
⑤FeCl3溶液 ⑥铜 ⑦ Fe(OH)3胶体 ⑧蔗糖,
(1)其中属于电解质的是 ,
(2)写出FeCl3的电离方程式:__________________________,
(3)写出NaHCO3(aq) 与稀盐酸反应的离子方程式:_____________________,
(4)胶体是一种常见的分散系,回答下列问题。
①向煮沸的蒸馏水中逐滴加入饱和FeCl3溶液,继续煮沸至溶液呈红褐色,
停止加热,可制得Fe(OH)3胶体,制取Fe(OH)3胶体化学反应方程式为 。
②向Fe(OH)3胶体中加入Na2SO4饱和溶液,由于_______离子(填离子符号)的作用,使胶体形成了沉淀,这个过程叫做胶体的聚沉。
③区分胶体和溶液常用的方法叫做 。
已知NO2和N2O4可以相互转化:2NO2(g)  N2O4(g) ΔH<0。现将一定量NO2和N2O4的混合气体通入一体积为2 L的恒温密闭玻璃容器中,反应物浓度随时间变化关系如图。
N2O4(g) ΔH<0。现将一定量NO2和N2O4的混合气体通入一体积为2 L的恒温密闭玻璃容器中,反应物浓度随时间变化关系如图。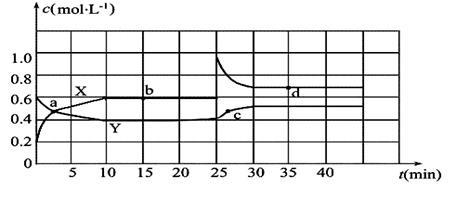
(1)图中共有两条曲线X和Y,其中曲线_______________表示NO2浓度随时间的变化;a、b、c、d四个点中,表示化学反应处于平衡状态的点是______________。
(2)①前10 min内用NO2表示的化学反应速率v(NO2)=__________mol·L-1·min-1。
②0~15 min ,反应2NO2(g)  N2O4(g)的平衡常数Kb=_______________。
N2O4(g)的平衡常数Kb=_______________。
③25 min~35 min时,反应2NO2(g)  N2O4(g)的平衡常数Kd_____________Kb(填“>”、“=”或“<”)。
N2O4(g)的平衡常数Kd_____________Kb(填“>”、“=”或“<”)。
(3)反应25 min时,若只改变了某一个条件,使曲线发生如上图所示的变化,该条件可能是_________________(用文字表达),若要达到使NO2(g)的百分含量与d点相同的化学平衡状态,在25 min时还可以采取的措施是_________________。
| A.加入催化剂 | B.缩小容器体积 |
| C.升高温度 | D.加入一定量的N2O4 |