完成下列各题
(1)工业上以氯气和石灰乳为原料制造漂白粉,漂白粉的有效成分是 (填“CaCl2”或“Ca(ClO)2”)。
(2)某些合成染发剂含有对苯二胺(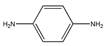 ),有一定的致癌作用。对苯二胺属于 (填“有机物”或“无机物”)。
),有一定的致癌作用。对苯二胺属于 (填“有机物”或“无机物”)。
(12分)现有反应:mA(g)+nB(g) pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
(1)该反应的逆反应为_________热反应,且m +n ________ p(填“>”“=”“<”)。
(2)减压时,A的质量分数_________。(填“增大”“减小”或“不变”,下同)
(3)若加入B(体积不变),则A的转化率__________。
(4)若升高温度,则平衡时B、C的浓度之比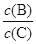 将_________。
将_________。
(5)若B是有色物质,A、C均无色,则加入C(体积不变)时混合物颜色_______ (填“变深”“变浅”或“不变”)。
将等物质的量的H2和I2充入体积为2 L的密闭容器中,进行反应:H2(g)+ I2(g) 2HI(g),测得2min内v (HI)= 0.1 mol•L-1•min-1,2min 后I2(g)的浓度为0.4 mol•L-1,试确定:
2HI(g),测得2min内v (HI)= 0.1 mol•L-1•min-1,2min 后I2(g)的浓度为0.4 mol•L-1,试确定:
(1)2min内以H2所表示的反应速率为___________________;
(2)I2的起始物质的量为___________________;
(3)2min末HI的浓度为___________________
如图,水槽中试管内有一枚铁钉,放置数天观察,铁钉有明显生锈的迹象: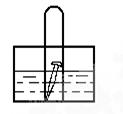
(1)若试管内液面上升,则溶液呈_____________性,电极反应式为:正极:______________
(2)若试管内液面下降,则溶液呈__________性,,正极电极反应式为:_______
了解一些用药常识,有利于自我保健。现有下列药物:碳酸镁、青霉素、阿司匹林、氢氧化铝,麻黄碱。
(1)其中属于解热镇痛的药物是__________。
(2)青霉素的作用是__________。
(3)药片常用淀粉作为黏合剂,淀粉水解的最终产物的结构简式是______________。
(4)碳酸镁可治疗胃酸过多的原理是________________________(用离子方程式表示)。
人们习惯上按不同的溶解性,把维生素分为水溶性维生素和_________性维生素两大类,维生素C溶液显酸性,又称为____________。