K2Cr2O7是一种橙红色具有强氧化性的化合物,当它在酸性条件下被还原成正三价铬时,颜色变为绿色。据此,当交警发现汽车行驶不正常时,就可上前阻拦,并让司机对填充了吸附有K2Cr2O7的硅胶颗粒的检验装置吹气。若发现硅胶变色达到一定程度,即可证明司机是酒后驾车。这时酒精被氧化为醋酸其反应原理如下:
2K2Cr2O7+3CH3CH2OH+8H2SO4=2K2SO4+2Cr2(SO4)3+3CH3COOH+11H2O
请结合上面的描述回答下列问题:
(1)将上述反应改写为离子方程式: 。
(2)如果司机属于醉酒驾车,则检验装置中的硅胶将由 色变为 色。
(3)上述反应中氧化剂是 ,还原剂是 ,氧化产物是 ,还原产物是 。(本题中的四个空都需填写物质的化学式)
(4)在上述反应中当有69g酒精发生反应时消耗K2Cr2O7的物质的量是
已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测其离子浓度大小顺序有以下几种
①c(Cl-)>c(NH4+)>c(H+)>c(OH-)
②c(Cl-)>c(NH4+)>c(OH-)>c(H+)
③c(NH4+)>c(Cl-)>c(OH-)>c(H+)
④c(Cl-)>c(H+)>c(NH4+)>c(OH-)
(1)上述关系一定不正确的是_______________(填序号);
(2)若溶液中只有一种溶质,则该溶质为__________,该溶液中离子浓度的大小关系为_______(填序号);
(3)若关系③正确,则溶液中溶质为_________;
(4)若四种离子浓度关系有c(NH4+)=c(Cl-),则该溶液显_________(填“酸性”、“碱性”、“中性”)。
(5)25℃,pH=a的盐酸VamL与pH=14-a的氨水VbmL混合,若溶液显中性,则Va__________Vb(填>、<、=、无法确定)。
用平衡移动原理分析外界条件对电离平衡的影响,如:以0.1 mol•L-1醋酸为例,对CH3COOH CH3COO-+H+进行分析:(填“增大”“减小”“不变”“正方向”“逆方向”)
CH3COO-+H+进行分析:(填“增大”“减小”“不变”“正方向”“逆方向”)
(1)当向该溶液中加水,则平衡向________方向移动;溶液的n(H+)_______;溶液的c(H+)_______;
(2)当向溶液中加入1 mol•L-1的醋酸时,平衡向_____方向移动;溶液的n(H+)_______;溶液的c(H+)_______。
写出下列电解质在水溶液中的电离方程式
(1)Ca(HCO3)2:_____________________________;
(2)H2SO3:_____________________________;
写出下列电解质在水溶液中的水解离子方程式
(3)CH3COONa:_____________________________;
(4)Fe2(SO4)3:_____________________________。
结合Na、Al、Fe的有关性质,回答下列问题。
(1)金属钠是具有银白色金属光泽的固体,常温下能与冷水剧烈反应,其反应的化学方程式为____________。
(2)铝既能与强酸反应,也能与强碱反应,且都放出H2,据此可区别铝和其他金属,请写出铝与氢氧化钠溶液反应的化学方程式_______________________。
(3)如下图所示,在玻璃管中放入还原铁粉和石棉绒的混合物,加热并通入水蒸气,用试管收集产生的经干燥的气体。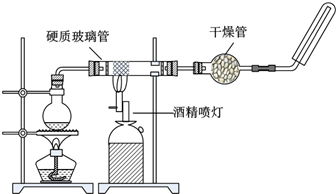
①有关反应的化学方程式是______________________。
②干燥管内可装入的试剂是_______________________。
阅读下列两条科普信息,回答问题。
①一个体重50Kg的健康人含铁2g,这2g铁在人体中不是以单质金属的形式存在,而是以Fe2+和Fe3+的形式存在.亚铁离子易被吸收,给贫血者补充铁时,应给予含亚铁离子的亚铁盐,如硫酸亚铁.服用维生素C,可使食物中的铁离子还原成亚铁离子,有利于铁的吸收。
②在新生代的海水里有一种铁细菌,它们提取海水中的亚铁离子,利用酶为催化剂把它转变成它们的皮鞘(可以用Fe2O3来表示其中的铁),后来便沉积下来形成铁矿;该反应的另一种反应物是CO2,反应后CO2转变成有机物(用甲醛:CH2O表示,其中H为+1价,O为-2价)。
(1)以下为常见的铁元素的几种微粒,其中既有氧化性又有还原性的是________(填字母)
A.Fe2+ B.Fe C.Fe3+
(2)在Fe +4HNO3=Fe(NO3)3+NO↑+2H2O的反应中,HNO3表现了______性和______性,则1molFe参加反应时,被还原的HNO3为______mol,转移电子的物质的量为______mol。
(3)第②信息中的CO2做氧化剂,写出②中的离子方程式:
CO2+____________+5H2O=CH2O+____________+8H+。