(共16分)
Ⅰ.(10分)已知2A(g)+B(g)  2C(g);△H=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2molA和1molB,在500℃时充分反应达平衡后C的浓度为w mol/L,放出热量b kJ。
2C(g);△H=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2molA和1molB,在500℃时充分反应达平衡后C的浓度为w mol/L,放出热量b kJ。
(1)比较a b( 填 > 、 = 、 < )
(2)若在原来的容器中,只加入2mol C,500℃时充分反应达平衡后,吸收热量ckJ,C物质的浓度 (填>、=、<)w mol/L,a、b、c之间满足的关系式为 (用含a、b、c的代数式表示)。
(3)能说明该反应已经达到平衡状态的是 。
a、V(C)=2V(B); b、容器内压强保持不变
c、V逆(A)=2V正(B) d、容器内的密度保持不变
(4)若将上述容器改为恒压容器(反应前体积相同),起始时加入2molA和lmolB,500℃时充分反应达平衡后,放出热量d kJ,则d b ( 填 > 、 = 、 < ),
Ⅱ.用吸收H2后的稀土储氢合金作为电池负极材料(用MH表示),
NiO(OH)作为电池正极材料,KOH溶液作为电解质溶液,可制得高容量,长寿命的镍氢电池。电池充放电时的总反应为:
NiO(OH)+MH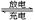 Ni(OH)2+M
Ni(OH)2+M
(1)电池放电时,负极的电极反应式为_______
(2)充电完成时,Ni(OH)2全部转化为NiO(OH)。若继续充电将在一个电极产生O2,O2扩散到另一个电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸,此时,阴极的电极反应式为________。
(1)室温下,在pH=12的NaCN溶液中,由水电离的c(OH—)为_______ mol·L-1。
(2)等体积的下列溶液中,阳离子的总物质的量最大的是_________(填序号)。
① 0.2 mol·L-1的CuSO4溶液② 0.1 mol·L-1的Na2CO3
③ 0.2 mol·L-1的KCl④ 0.1 mol·L-1的Na2SO4
(3)浓度为0.100 mol·L-1的下列各物质的溶液中,c(NH4+)由大到小的顺序是_______(填序号)。
①NH4Cl②NH4HSO4③NH3·H2O④CH3COONH4
(4)某二元酸(化学式用H2A表示)在水中的电离方程式是:
H2A ="===" H++ HA- , HA- H++ A2-。
H++ A2-。
①则Na2A溶液显________(填“酸性”“中性”或“碱性”);NaHA溶液显________(填“酸性”“中性”或“碱性”)。
②若有0.1 mol·L-1 Na2A的溶液,其中各种离子浓度由大到小的顺序是:(填序号)。
A.c(Na+)>c(A2-)>c( OH-)>c(HA-)>c(H+) OH-)>c(HA-)>c(H+) |
| B.c(Na+)>c(OH-)>c(HA-)>c(A2-)>c(H+) |
| C.c(Na+)>c(H+)>c(A2-)>c(OH-)>c(HA-) |
| D.c(A2-)>c(Na+)>c(OH-)>c(H+)>c(HA-) |
一定温度下,将3mol A气体和1mol B气体通入一密闭容器中,发生如下反应:3A(g)+B (g) xC(g)。请填写下列空白:
xC(g)。请填写下列空白:
(1)若容器体积固定为2L,反应1min时测得剩余1.8molA,C的浓度为0.4 mol·L-1。
①则1min内,B的平均反应速率为_________,x=_________;
②若反应经2min达到平衡,平衡时C的浓度_________0.8 mol·L-1 (填“大于”、“等于”或“小于”);
③若平衡混合物中C的体积分数为22%,则A的转化率是_________;
④若改变起始物质的加入量,欲使反应达到平衡时C的物质的量分数与原平衡相等,则起始加入的三种物质的物质的量n(A)、n(B)、n(C)之间应满足的条件_________(可用两个方程表示,其中一个用n(A)和 n(C),另一个用n(B)和n(C)表示)。
(2)若维持容器压强不变。
①达到平衡时C的体积分数_________22%,(填“大于”、“等于”或“小于”);
②若改变起始物质的加入量,欲使反应达到平衡时C的物质的量是原平衡的2倍,则应加入______molA气体和_______molB气体。
能量是一个世界性的话题,如何充分利用能量、开发新能源,为人类服务是广大科技工作者不懈努力的目标。
(1)如图所示,组成一个原电池.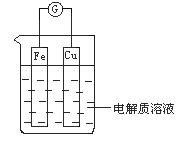
①当电解质溶液为稀硫酸时:
Cu电极是_____(填“正”或“负”)极,其电极反应为____;
②当电解质溶液为浓硝酸时:
Cu电极是_____极,其电极反应为__________。
(2)请写出电解硫酸铜溶液的总化学方程式。
(3)燃烧氢气时耗氧量小,放出热量多。已知4g H2燃烧生成液态水时放热为571.6kJ,试写出表示H2燃烧热的热化学方程式为:。
(4)下图是一碳酸盐燃料电池(MCFC),以水煤气(CO、H2)为燃料,一定比例Li2CO3和Na2CO3低熔混合物为电解质。写出B极发生的电极反应式:。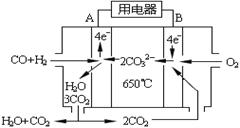
(5)请根据下面所给出的5个热化学方程式,判断反应④的反应热ΔH4是________。
①NH3(g)+HCl(g)===NH4Cl(s) ΔH1=-176 kJ·mol-1
②NH3(g)+H2O(l)===NH3·H2O(aq) ΔH2=-35.1 kJ·mol-1
③HCl(g)+H2O(l)===HCl(aq) ΔH3=-72.3 kJ·mol-1
④NH4Cl(s)+H2O(l)===NH4Cl(aq) ΔH4=?
⑤NH3·H2O(aq)+HCl(aq)===NH4Cl(aq)+H2O(l) ΔH5=-52.3 kJ·mol-1
结构决定性质,性质体现结构。对结构和性质的研究是学好化学的基础。
(1)N、O、S三种元素的第一电离能大小顺序为:>>。(填元素符号)
(2)某晶体的晶胞如图所示,X位于体心,Y位于4个面心,Z位于8个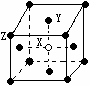 顶点,该晶体中 X、Y、Z的粒子个数比为______________;
顶点,该晶体中 X、Y、Z的粒子个数比为______________;
(3)按所示格式填写下表有序号的空格:
| 原子序数 |
原子价层电子排布 |
周期 |
族 |
| 17 |
① |
第三 |
② |
| ③ |
3d54s1 |
④ |
ⅥB |
(4)某元素的激发态原子的电子排布式为1s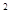 2s
2s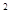 2p
2p 3s
3s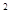 3p
3p 4s
4s ,则该元素的最高价氧化物对应的水化物的化学式是。
,则该元素的最高价氧化物对应的水化物的化学式是。
(5)NH4CuSO3中的金属阳离子的核外电子排布式为。
(1)在我国使用最早的合金是,目前用量最大,用途最广泛的合金是。
(2)0.5 mol H2O 的质量为g,共有个原子。
(3)质量都是50g 的Cl2、NH3、CO2、O2四种气体中,含有分子数最少的是;在相同的温度和压强下,体积最大的是。
(4)配制50mL 0.2mol/L CuSO4溶液,需要CuSO4•5H2O g。
(5)氯气可用于自来水的杀菌、消毒,请用化学方程式和简要的文字说明理由:
。