肼是重要的化工原料。某探究小组利用下列反应制取水合肼(N2H4·H2O)。CO(NH2) + 2NaOH + NaClO = Na2CO3 + N2H4·H2O + NaCl
实验一:制备NaClO溶液
(1)将氯气通入到盛有NaOH的锥形瓶中,锥形瓶中发生反应的离子方程式是 ;
实验二:制取水合肼(实验装置如图所示)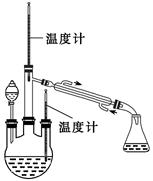
控制反应温度,将分液漏斗中溶液缓慢滴入三颈烧瓶中,充分反应。加热蒸馏三颈烧瓶内的溶液,收集108~114℃馏分。(已知:N2H4·H2O + 2NaClO=N2↑ + 3H2O + 2NaCl)
(2)分液漏斗中的溶液是 (填标号A或B);
A.NaOH和NaClO混合溶液
B.CO (NH2) 2溶液
选择的理由是 ;
实验三:测定馏分中肼含量水合肼具有还原性,可以生成氮气。测定水合肼的质量分数可采用下列步骤:
a.称取馏分5.000g,加入适量NaHCO3固体,经稀释、转移、定容等步骤,配制250mL溶液。
b.移取25.00 mL于锥形瓶中,加入10mL水,摇匀.
c.用0.2000mol/L碘溶液滴定至溶液出现微黄色且半分钟内不消失,滴定过程中,溶液的pH保持在6.5左右。记录消耗碘的标准液的体积。
d.进一步操作与数据处理
(3)水合肼与碘溶液反应的化学方程式 ;滴定过程中,NaHCO3能控制溶液的pH在6.5左右,原因是 。
(4)滴定时,碘的标准溶液盛放在 滴定管中(选填:“酸式”或“碱式”);若本次滴定消耗碘的标准溶液为18.00mL,馏分中水合肼(N2H4·H2O)的质量分数为 (保留三位有效数字);
(5)为获得更可靠的滴定结果,步骤d中进一步操作主要是: 。
用如图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应。下列实验不合理的是
| A.上下移动①中铜丝可控制生成SO2的量 |
| B.②中选用品红溶液验证SO2的生成 |
| C.③中选用NaOH溶液吸收多余的SO2 |
| D.该反应中浓硫酸体现了强氧化性和脱水性 |
(1)某课外小组设计的实验室制取乙酸乙酯的装置如下图所示,A中盛有浓硫酸,B中盛有乙醇、乙酸,D中盛有饱和碳酸钠溶液。
请回答:
① 乙醇与乙酸制取乙酸乙酯的反应类型是 。
② 若用18O标记乙醇中的氧原子,则CH3CH218OH与乙酸反应的化学方程式是 。
③ 球形干燥管C的作用是 。
④ D中选用饱和碳酸钠溶液的原因是 。
⑤ 反应结束后D中的现象是 。
(2)下列叙述正确的是 (填字母)。
| A.向碘水中加入酒精,萃取碘水中的碘 |
| B.液化石油气、汽油和石蜡的主要成分都是碳氢化合物 |
| C.用淀粉水解液做银镜反应,若有银镜产生,则证明淀粉部分水解 |
| D.将无水乙醇和浓硫酸按体积比1∶3混合,加热至140℃制取乙烯 |
E.为证明溴乙烷中溴元素的存在,可向溴乙烷中加入NaOH溶液,加热;冷却后,加入稀硝酸至溶液呈酸性,滴入AgNO3溶液观察是否有淡黄色沉淀生成
为研究A的组成与结构,某同学进行了如下实验:
| 实 验 步 骤 |
实 验 结 论 |
| (1)将9.0 g A在足量纯O2中充分燃烧,并使其产物依次缓缓通过足量的浓硫酸和碱石灰,发现两者分别增重5.4 g和13.2 g。 |
(1)A的实验式为 。 |
| (2)通过质谱法测得其相对分子质量为90。 |
(2)A的分子式为 。 |
| (3)另取9.0 g A,跟足量的NaHCO3粉末反应,生成2.24 L CO2(标准状况),若与足量金属钠反应则生成2.24 L H2(标准状况)。 |
(3)A中含有的官能团名称为 。 |
| (4)A的核磁共振氢谱有四组吸收峰,其峰面积之比为2︰2︰1︰1。 |
(4)综上所述,A的结构简式为 。 (5)写出A与NaHCO3反应的化学方程式 。 |
研究NO、NO2、SO2等大气污染气体的处理具有重要意义。
(1)以石灰石为原料通过系列反应将硫元素以CaSO4的形式固定,从而降低SO2的排放.但是煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低脱硫效率。相关反应的热化学方程式如下:
CaSO4 (s)+CO (g)  CaO(s)+SO2 (g)+CO2 (g)△H=218.4kJ·mol-1(反应Ⅰ)
CaO(s)+SO2 (g)+CO2 (g)△H=218.4kJ·mol-1(反应Ⅰ)
CaSO4 (s) +4CO (g) CaS(s) +4CO2(g)△H2=﹣175.6kJ·mol-1 (反应Ⅱ)
CaS(s) +4CO2(g)△H2=﹣175.6kJ·mol-1 (反应Ⅱ)
结合反应Ⅰ、Ⅱ写出CaSO4 (s)与CaS (s) 反应的热化学反应方程式 。
(2)NO2、SO2气体混合存在氧化物间的相互转化平衡:
NO2(g)+SO2(g) SO3(g)+NO(g),某活动小组对此反应进行研究实验
SO3(g)+NO(g),某活动小组对此反应进行研究实验
| 实验内容 |
实验现象 |
结论 |
|
| ① |
将充有NO2、SO2气体的密闭烧瓶放入热水中 |
气体红棕色加深,一段时间后颜色不再变化 |
△H 0(填“>”、“<”或“=”) |
② |
在针筒中抽入5mL NO2和5mL SO2气体,封闭针筒前端,充分反应后,将活塞迅速推至5mL处 |
气体红棕色加深并保持不变 |
平衡 (填“向左”、“向右”或“不”)移动 |
③ |
在充有NO2、SO2混合气体的恒容容器中,达平衡后继续通入SO2气体 |
平衡向右移动,SO2的转化率 (填“增大”、“减小”或“不变”) |
(3)工业上用活性炭还原法处理NO,有关反应为:C(s) +2NO(g) N2(g) +CO2(g)。
N2(g) +CO2(g)。
为了提高NO的转化率,下列的措施可行的是
A.再加入一定量的碳 B.增大压强
C.用碱液吸收气体 D.使用催化剂
(4)用间接电化学法除去NO的原理如图所示。已知电解池的阴极室中溶液呈酸性,阴极的电极反应式为 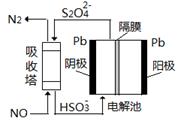
某碳酸钠样品中含有少量氯化钠杂质,为测定该样品中碳酸钠的质量分数,进行了如下实验: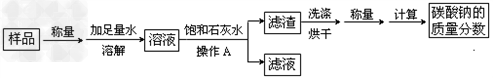
请回答下列问题:
(1)操作A用到的玻璃仪器除烧杯外还必需有 、 ;
(2)在实验过程中加入饱和石灰水后发生反应的离子方程式是
(3)为探究上述反应后滤液中的溶质成分,甲同学向滤液中滴加过量稀盐酸,发现无气泡产生,说明滤液中一定不含 (填溶质的化学式),若有气泡产生,那么测定的样品中碳酸钠的质量分数 (填偏大、偏小、无影响)
(4)在(3)探究中,滴加盐酸前滤液中的溶质除氯化钠外,一定还含有 (填化学式) ;
滴加盐酸的过程中一定发生反应的离子方程式为 。