I.还原剂还原法、光催化氧化法、电化学吸收法是减少氮氧化物排放的有效措施。
(1)利用炭粉可以将氮氧化物还原。
已知:N2(g)+O2(g)=2NO(g) ΔH=+180.6 kJ·mol-1
C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
反应:C(s)+2NO(g)=CO2(g)+N2(g) ΔH=_____kJ·mol-1。
(2)TiO2在紫外线照射下会使空气中的某些分子产生活性基团OH,OH能将NO、NO2氧化,如下图所示,OH与NO2的反应为NO2+OH=HNO3。
写出OH与NO反应的化学方程式:_____________。
II.甲醇、乙醇是重要的有机化工原料,有着重要的用途和应用前景。
(3)若在恒温恒容的容器内进行反应CO(g)+2H2(g) CH3OH(g),则可用来判断该反应达到平衡状态的标志有 (填字母)。
CH3OH(g),则可用来判断该反应达到平衡状态的标志有 (填字母)。
| A.H2百分含量保持不变 |
| B.容器中气体的压强保持不变 |
| C.容器中混合气体的密度保持不变 |
| D.2v(H2)正= v(CH3OH )逆 |
(4)CO(g)+2H2(g) CH3OH(g) 其平衡常数表达式为K=___________。该反应的平衡常数K 随温度T 的变化如图所示,
CH3OH(g) 其平衡常数表达式为K=___________。该反应的平衡常数K 随温度T 的变化如图所示,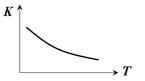
则该反应的 △H 0。(填“>”、“<”或“=”)。已知该反应在300℃时的化学平衡常数为0.27,该温度下将2 mol CO、3 mol H2和2 mol CH3OH充入容积为2 L的密闭容器中,此时反应将 (填“向正反应方向进行”、“向逆反应方向进行”或“处于平衡状态”)。
(5)下图所示是一种酸性燃料电池乙醇检测仪,具有自动吹气流量侦测与控制的功能,适合进行现场乙醇检测。负极反应式为_________。
(I)过氧化尿素[CO(NH2)2·H2O2]是一种无毒、无味的白色结晶粉末,具有尿素和过氧化氢双重性质,是一种新型的氧化剂和消毒剂,广泛应用于漂白、纺织、医药、农业、养殖业等领域。其合成如下: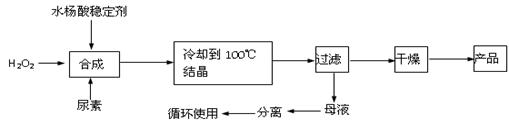
试回答下列问题:
(1)实际生产中需控制n(H2O2)∶n[CO(NH2)2]=1.2∶1,并控制合成温度在25~30℃,其主要原因是。
(2)从母液中分离出H2O2和尿素,采用的操作是 。
(a)盐析过滤 (b)分液过滤 (c)减压蒸馏结晶 (d)常压蒸馏萃取
(II)某硝酸厂附近的空气主要污染物为氮的氧化物,为了保护环境和综合利用,可采用氨-碱两级吸收法,此法兼有碱吸收和氨吸收两法的优点,其吸收工艺流程如下: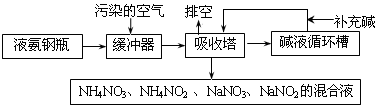
(1)排空物质的主要成分为____________________________。
(2)进入吸收塔以前加一个缓冲器的目的是________________________________。
(3)从吸收塔排出的混合液用途之一为________________ 。
(4)空气的主要污染物为硫的氧化物和氮的氧化物.研究人员设计了同时净化废气中二氧化硫和氮的氧化物的方法,将其转化为硫酸和硝酸,工艺流程如下:
则①和②分别为(写化学式)________________。
碳、氮和铝的单质及其化合物在工农业生产和生活中有重要的作用。
(1)真空碳热还原—氯化法可实现由铝矿制备金属铝,其相关的热化学方程式如下:
2Al2O3(s)+2AlCl3(g)+6C(s)=6AlCl(g)+6CO(g)△H=a kJ·mol-1
3AlCl(g)=2Al(l)+AlCl3(g)△H=b kJ·mol-1
反应Al2O3(s)+3C(s)=2Al(l)+3CO(g)的△H=kJ·mol-1(用含a、b的代数式表示);
(2)用活性炭还原法可以处理氮氧化物。某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C (s)+2NO(g) N2(g)+CO2(g)△H=Q kJ·mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g)△H=Q kJ·mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
| 时间(min) 浓度(mol/L) |
0 |
10 |
20 |
30 |
40 |
50 |
| NO |
1.00 |
0.68 |
0.50 |
0.50 |
0.60 |
0.60 |
| N2 |
0 |
0.16 |
0.25 |
0.25 |
0.30 |
0.30 |
| CO2 |
0 |
0.16 |
0.25 |
0.25 |
0.30 |
0.30 |
①T1℃时,该反应的平衡常数K=;
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是(填字母编号)。
a.通入一定量的NO b.加入一定量的活性炭
c.加入合适的催化剂 d.适当缩小容器的体积
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为3∶1∶1,则
Q0(填“>”或“<”)。
④在恒容条件下,能判断该反应一定达到化学平衡状态的依据是(填选项编号)。
a.单位时间内生成2n mol NO(g)的同时消耗n mol CO2(g)
b.反应体系的温度不再发生改变
c.混合气体的密度不再发生改变
d.反应体系的压强不再发生改变
(3)铝电池性能优越,Al—Ag2O电池可用作水下动力电源,其原理如下左图所示:请写出该电池正极反应式;常温下,用该化学电源和惰性电极电解300ml硫酸铜溶液(过量), 消耗27mg Al,则电解后溶液的pH=(不考虑溶液体积的变化)。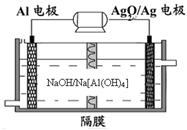
A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A元素的原子半径最小;B元素的最高价氧化物对应水化物与其氢化物能生成盐;D与A同主族,且与E同周期;E元素原子的最外层电子数是其次外层电子数的3/4,A、B、D、E这四种元素,每一种与C元素都能形成元素的原子个数比不相同的若干种化合物。
请回答下列问题: (1)B单质的电子式是,C和E两种元素相比较,非金属性可以验证该结论的是(填写编号);
(1)B单质的电子式是,C和E两种元素相比较,非金属性可以验证该结论的是(填写编号);
A.比较这两种元素的常见单质是沸点
B.比较这两种元素的单质与氢气化合的难易
C.比较这两种元素的气态氢化物的稳定性
(2)A、B、C、E可形成两种酸式盐(均由四种元素组成),两种酸式盐相互反应的离子方程式为;
(3)A、C、E间可形成甲、乙两种微粒,它们均为负一价双原子阴离子,且甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为;
(4)①在火箭推进器中装有液态B2A4和液态A2C2,已知0.4mol液态B2A2和足量液态A2C2反应,生成气态B2和气态A2C,放出256.6kJ的热量。试写出该反应的热化学方程式:;
②B2A4是一种可燃性液体,B2A4——空气燃料电池是一种碱性燃料电池,电解质溶液是20%—30%的KOH溶液,该电池放电时的负极反应式为:。
③右图是一个电解装置示意图,假设使用B2A4——空气燃料电池作为本装置中的电源,通电前两极铜片的质量相等,通电一段时间后两极铜片的质量相差12.8g,则通过电路的电子的物质的量为。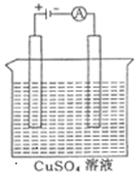
某同学发现,纯度、质量、表面积都相同的两铝片与c(H+)相同的盐酸和硫酸在同温同压下反应时产生氢气的速率差别很大,铝与盐酸反应速率更快。他决定对其原因进行探究。填写下列空白:
(1)该同学认为:由于预先控制了反应的其他条件,那么,两次实验时反应的速率不一样的原因,只有以下五种可能:原因Ⅰ:Cl-对反应具有促进作用,而SO42-对反应没 有影响;
原因Ⅱ:_________________________________;
原因Ⅲ:Cl-对反应具有促进作用,而SO42-对反应具有阻 碍作用;
原因Ⅳ:Cl-、SO42-都对反应具有促进作用,但Cl-影响更大;
原因Ⅴ: _________________________________。
(2)该同学设计进行了两组实验,即得出了正确的结论。他取了两片等质量、外形和组成相同、表面经过砂纸充分打磨的铝片,分别放入到盛有同体积、c(H+)相同的稀硫酸和盐酸的试管(两试管的规格相同)中:
①在盛有硫酸的试管中加入少量NaCl或KCl固体,观察反应速率是否变化。
②在盛有盐酸的试管中加入少量Na2SO4或K2SO4固体,观察反应速率是否变化。
③若观察到实验①中_____ ,实验②中_____ ,则说明原因Ⅲ是正确的。依此类推。该同学通过分析实验现象,得出了结论:Cl-对反应具有促进作用。
A、B、C、D、E是位于短周期的主族元素。已知:①热稳定性:HmD>HmC;②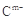 、
、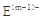 具有相同的电子层结构;③A与B在同一周期,在该周期所有主族元素中,A的原子半径最大,B的离子半径最小;④A与B质子数之和是D质子数的3倍。依据上述信息用相应的化学用语回答下列问题:
具有相同的电子层结构;③A与B在同一周期,在该周期所有主族元素中,A的原子半径最大,B的离子半径最小;④A与B质子数之和是D质子数的3倍。依据上述信息用相应的化学用语回答下列问题:
(1)HmDm的电子式___________________。
(2)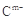 、
、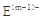 的还原性强弱顺序为:_________,能证明其还原性强弱的离子方程式为______。
的还原性强弱顺序为:_________,能证明其还原性强弱的离子方程式为______。
(3)将E的单质通入A与D形成的化合物的水溶液中,其离子方程式为:_____________________。
(4)常温下,将等物质的量浓度的HmC溶液和A的最高价氧化物对应的水化物溶液等体积混合,写出该反应的离子方程式。在该溶液中溶质中含有的化学键类型是。
(5)在A、B、C、E单质中,符合下列转化关系的是_____________(填元素符号)。