盐酸、硫酸和硝酸是中学阶段常见的“三大酸”。现就硫酸、硝酸与金属铜反应的情况,回答下列问题:
(1)工业上制备硫酸铜是利用废铜屑经灼烧后,在加热情况下跟稀硫酸反应,有关的化学方程式是 。不采用铜跟浓硫酸反应来制取硫酸铜的原因是
(2)在一定体积的10 mol·L-1的浓硫酸中加入过量铜片,加热使之反应,被还原的硫酸为0.9 mol。则浓硫酸的实际体积 (填“大于”、“等于”或“小于”)180 mL。
(3)若使剩余的铜片继续溶解,可在其中加入硝酸盐溶液(如KNO3溶液),则该反应的离子方程式为
(4)将8 g Fe2O3投入到150 mL某浓度的稀硫酸中,再投入7 g铁粉,充分反应后,收集到1.68 L H2(标准状况),同时,Fe和Fe2O3均无剩余,为了中和过量的硫酸,且使溶液中铁元素完全沉淀,共消耗4 mol·L-1的NaOH溶液150 mL。则原硫酸的物质的量浓度为
钢化玻璃是一类性能良好的玻璃,它可以克服玻璃质脆易碎的缺点。离子交换法是玻璃进行钢化的一种重要方法。将普通的钠钙玻璃在碳酸钾的强化盐(475 ℃)中浸泡3.5小时后即可制得。下图是离子交换法的示意图。
(1)普通玻璃是由石英砂、__________和__________高温熔融而成。
(2)普通玻璃表面产生裂纹后非常容易破碎,清除表面裂纹的物质之一是氢氟酸,写出氢氟酸与玻璃反应的化学方程式________________。
(3)玻璃进行钢化过程中,离子交换是__________(填“物理变化”或“化学变化”)。
(4)在玻璃进行钢化处理时,能否用碳酸氢钾代替碳酸钾,__________(填“能”或“不能”),原因是______________________________。
使用某些高分子材料给环境造成“白色污染”,后果严重。最近研究的一些可分解性塑料有良好的生物适应性和分解性,能自然腐烂分解。如:
已知3HB的单体叫3羟基丁酸,则
(1)4HB的单体名称是____________;3HV的单体名称是____________。
(2)两分子3HV的单体脱水时,生成的环酯的结构简式是____________________。
某些废旧塑料可采用下列方法处理:将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如下图所示。
加热聚丙烯废塑料得到的产物如下表:
| 产物 |
氢气 |
甲烷 |
乙烯 |
丙烯 |
苯 |
甲苯 |
碳 |
| 质量分数/% |
12 |
24 |
12 |
16 |
20 |
10 |
6 |
(1)试管A中残余物有多种用途,如下列转化就可制取高聚物聚乙炔。
A中残留物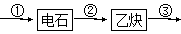 聚乙炔
聚乙炔
写出反应②③的化学方程式:__________________________。
(2)B中收集得到的物质中能使酸性KMnO4溶液褪色的物质的一氯代物有________种。
(3)锥形瓶C中观察到的现象是______________。经溴水充分吸收,剩余气体经干燥后平均相对分子质量为________。
(4)写出C中逸出的气体在工业上的两种用途__________、____________。
有机高分子化合物在日常生活中有非常广泛的应用。一种广泛应用于电器、工业交通的工程塑料DAP的结构简式是:
试回答:
(1)生产DAP工程塑料的单体的结构简式是__________________________。
(2)DAP工程塑料的单体,可以由两种有机物通过一步反应合成出来,则这两种有机物的结构简式是____________________和_______________。
最近医用化学杂志报道,用聚乙交酯纤维材料所制成的医用缝合线比天然高分子材料(如肠线)还好。聚乙交酯纤维的化学结构简式可表示为 ,它是用中间有机物
,它是用中间有机物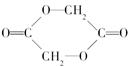 聚合而成的。
聚合而成的。
(1)试推导聚乙交酯纤维的单体______________________________________。
(2)写出有关反应的化学方程式______________________________________。