甲醇是重要的化学工业基础原料和清洁液体燃料。工业上可利用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
| 化学反应 |
平衡 常数 |
温度℃ |
|
| 500 |
800 |
||
①2H2(g)+CO(g) CH3OH(g) CH3OH(g) |
K1 |
2.5 |
0.15 |
②H2(g)+CO2(g) H2O (g)+CO(g) H2O (g)+CO(g) |
K2 |
1.0 |
2.50 |
③3H2(g)+CO2(g) CH3OH(g)+H2O (g) CH3OH(g)+H2O (g) |
K3 |
|
|
(1)反应②是 (填“吸热”或“放热”)反应。
(2)某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系,如图所示。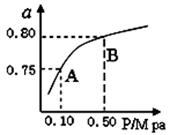
则平衡状态由A变到B时,平衡常数K(A) K(B)(填“>”、“<”或“=”)。据反应①与②可推导出K1、K2与K3之间的关系,则K3= (用K1、K2表示)。
(3)在3 L容积可变的密闭容器中发生反应②,已知c(CO)与反应时间t变化曲线Ⅰ如图所示,
若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ。当曲线Ⅰ变为曲线Ⅱ时,改变的条件是 。当曲线Ⅰ变为曲线Ⅲ时,改变的条件是 。
某同学发现,纯度、质量、表面积都相同的两铝片与c(H+)相同的盐酸和硫酸在同温同压下反应时产生氢气的速率差别很大,铝与盐酸反应速率更快。他决定对其原因进行探究。填写下列空白:
(1)该同学认为:由于预先控制了反应的其他条件,那么,两次实验时反应的速率不一样的原因,只有以下五种可能:原因Ⅰ:Cl-对反应具有促进作用,而SO42-对反应没 有影响;
原因Ⅱ:_________________________________;
原因Ⅲ:Cl-对反应具有促进作用,而SO42-对反应具有阻 碍作用;
原因Ⅳ:Cl-、SO42-都对反应具有促进作用,但Cl-影响更大;
原因Ⅴ: _________________________________。
(2)该同学设计进行了两组实验,即得出了正确的结论。他取了两片等质量、外形和组成相同、表面经过砂纸充分打磨的铝片,分别放入到盛有同体积、c(H+)相同的稀硫酸和盐酸的试管(两试管的规格相同)中:
①在盛有硫酸的试管中加入少量NaCl或KCl固体,观察反应速率是否变化。
②在盛有盐酸的试管中加入少量Na2SO4或K2SO4固体,观察反应速率是否变化。
③若观察到实验①中_____ ,实验②中_____ ,则说明原因Ⅲ是正确的。依此类推。该同学通过分析实验现象,得出了结论:Cl-对反应具有促进作用。
A、B、C、D、E是位于短周期的主族元素。已知:①热稳定性:HmD>HmC;②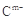 、
、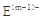 具有相同的电子层结构;③A与B在同一周期,在该周期所有主族元素中,A的原子半径最大,B的离子半径最小;④A与B质子数之和是D质子数的3倍。依据上述信息用相应的化学用语回答下列问题:
具有相同的电子层结构;③A与B在同一周期,在该周期所有主族元素中,A的原子半径最大,B的离子半径最小;④A与B质子数之和是D质子数的3倍。依据上述信息用相应的化学用语回答下列问题:
(1)HmDm的电子式___________________。
(2)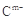 、
、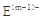 的还原性强弱顺序为:_________,能证明其还原性强弱的离子方程式为______。
的还原性强弱顺序为:_________,能证明其还原性强弱的离子方程式为______。
(3)将E的单质通入A与D形成的化合物的水溶液中,其离子方程式为:_____________________。
(4)常温下,将等物质的量浓度的HmC溶液和A的最高价氧化物对应的水化物溶液等体积混合,写出该反应的离子方程式。在该溶液中溶质中含有的化学键类型是。
(5)在A、B、C、E单质中,符合下列转化关系的是_____________(填元素符号)。
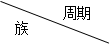
下表是元素周期表的一部分,按要求回答下列有关问题:
 |
IA |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
O |
| 2 |
① |
② |
||||||
| 3 |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
|
| 4 |
⑩ |
⑪ |
⑫ |
(1)在这些元素中,最活泼的金属元素是_____(填写元素符号,下同);最活泼的非金属元素是_______;最不活泼的元素是________。
(2)画出⑥原子的结构示意图________;⑩离子结构示意图________。
(3)在这些元素的最高价氧化物对应水化物中,酸性最强的是________;(填写物质的化学式,下同)碱性最强的是________;呈两性的氢氧化物是________。
(4)画出④和⑧形成的化合物的电子式。
(5)在③与④中,化学性质较活泼的是________,怎样用化学实验证明:________。
现有如下两个反应:
A.NaOH + HCl=NaCl + H2O
B.2FeCl3+Cu=2FeCl2+CuCl2
(1)根据两反应本质, 判断能否设计成原电池:A。_______, B。________(选择“能”或“不能”);
(2)如果不能, 说明其原因_____________________________________;
(3)如果可以, 则写出正、负极材料及其电极反应式, 电解质溶液名称:
负极材料________,电极反应式_______________,电解质溶液名称____________,
正极材料________,电极反应式_______________。
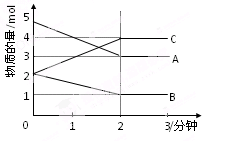
(10分)(1)请选择合适方法的字母代号填空:
①从海水中提取粗盐________;② 煤转化为焦炭、煤焦油等________;
③ 工业上由氧化铝制取金属铝________;④ 提纯氢氧化铁胶体________。
A.过滤 B.裂解 C.分馏 D.裂化 E.干馏 F.还原
G.电解 H.溶解 I.渗析 J.蒸发 K.氧化
(2)某可逆反应从0—2分钟进行过程中, 在不同反应时间各物质的量的变化情况如右图所示。则该反应的的反应物是,生成物是,此反应(填是或不是)可逆反应;反应开始至2分钟时, _____(能或不能)用C表示反应速率,2分钟后A、B、C各物质的量不再随时间的变化而变化,说明在这个条件下,反应已达到了 ____状态,此时正反应速率逆反应速率(填等于或不等于)。