全国各地都遭遇“十面霾伏”。其中,机动车尾气和燃煤产生的烟气对空气质量恶化贡献较大。
Ⅰ.(1)汽车尾气净化的主要原理为:2NO(g) + 2CO(g) 2CO2(g)+ N2(g) △H<0
2CO2(g)+ N2(g) △H<0
若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是 (填代号)。(下图中υ正、K、n、w分别表示正反应速率、平衡常数、物质的量、质量分数)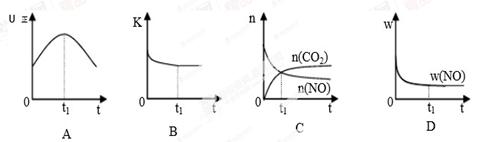
(2)机动车尾气和煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOX可以消除氮氧化物的污染。已知:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867 kJ/mol
2NO2(g) N2O4(g) △H=-56.9 kJ/mol
N2O4(g) △H=-56.9 kJ/mol
H2O(g) = H2O(l) ΔH = -44.0 kJ/mol
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式: 。
Ⅱ.SO2和NOx都是大气污染物。
(3)空气中的NO2可形成硝酸型酸雨,该反应的化学方程式是
(4)利用氨水可以将SO2和NO2吸收,原理如下图所示:
NO2被吸收的离子方程式是 。
(5)利用下图所示装置(电极均为惰性电极)也可吸收SO2,并用阴极排出的溶液吸收NO2。
①a为电源的 (填“正极”或“负极”),阳极的电极反应式为 。
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有SO32-生成。该反应中氧化剂与还原剂的物质的量之比为 。
(6)工业制硫酸的过程中利用反应2SO2(g)+O2(g) 2SO3(g);△H<0,一定条件下,向一带活塞的密闭容器中充入2molSO2和1molO2,则下列说法正确的是 。
2SO3(g);△H<0,一定条件下,向一带活塞的密闭容器中充入2molSO2和1molO2,则下列说法正确的是 。
| A.若反应速率v(SO2)=v(SO3),则可以说明该可逆反应已达到平衡状态 |
| B.保持温度和容器体积不变,充入2 mol N2,化学反应速率加快 |
| C.平衡后仅增大反应物浓度,则平衡一定右移,各反应物的转化率一定都增大 |
| D.平衡后移动活塞压缩气体,平衡时SO2、O2的百分含量减小,SO3的百分含量增大 |
E.保持温度和容器体积不变,平衡后再充入2molSO3,再次平衡时各组分浓度均比原平衡时的浓度大
F.平衡后升高温度,平衡常数K增大
某结晶水合物含有两种阳离子和一种阴离子。称取两份质量均为1.96g的该结晶水合物,分别制成溶液。
一份加入足量Ba(OH)2溶液,生成白色沉淀,随即沉淀变为灰绿色,最后带有红褐色;加热该混合物,逸出0.224L(标准状况)能使湿润的红色石蕊试纸变蓝的气体;用稀盐酸处理沉淀物,经洗涤和干燥,得到白色固体2.33 g。
g。
另一份加入含0.001molKMnO4的酸性溶液,MnO4-恰好完全被还原为Mn2+。
请回答以下问题:
(1)该结晶水合物中含有的两种阳离子是_____________和_____________,阴离子是__________________________。
(2)该结晶水合物的化学式_______________________________________。
某些金属氧化物跟熔融烧碱反应可生成盐,根据图中化学反应方框图填空: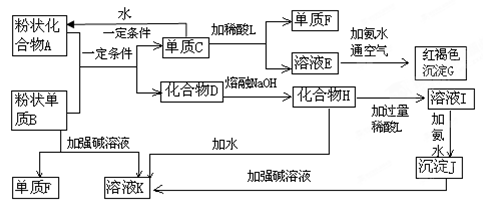
(1)单质F是________;
(2)写出由E生成G的离子方程式(或化学方程式)_______;
(3)溶液I中所含金属离子是________;
(4)由C E+F若改用浓酸,则不能选用的浓酸是(写分子式)________。
E+F若改用浓酸,则不能选用的浓酸是(写分子式)________。
(5)写出单质C转化为A的化学方程式:___________________________________。
(6)化合物A与盐酸反应的离子方程式为:_____ ______________________________。
______________________________。
用下面方法可以制得白色的Fe(OH)2沉淀 用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。
(1)用硫酸亚铁晶体配制上述FeSO4溶液时还需加入;
(2)除去蒸馏水中溶解的氧 气常采用的方法;
气常采用的方法;
(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是。
现有下列10种物质:①铁片;②饱和食盐水;③液态硫酸;④乙醇;⑤干冰;⑥熔融硝酸钾;⑦碳酸钙固体;⑧铝条;⑨苛性钠;⑩石墨。
(1)用序号回答:能导电的是______________,属于电解质的是___________________,属于非电解质的是___________________。
(2)储氢纳米碳管的研制成功体现了科技的进步。用电弧法合成的碳纳米管常伴有大量的杂质——碳纳米颗粒。这种碳纳米颗粒可用氧化气化法提纯。 C、CO2、H2SO4、K2Cr2O7、K2SO4、Cr2(SO4)3和H2O七种。
向50mL 1mol/L的Al2(SO4)3溶液中加入50mLKOH 溶液,充分反应得到3.9g沉淀,则KOH溶液的物质的量浓度可能是或。
溶液,充分反应得到3.9g沉淀,则KOH溶液的物质的量浓度可能是或。