钡在氧气中燃烧时得到一种钡的氧化物晶体,结构如图所示,有关说法不正确的是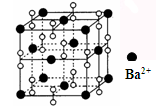
| A.该晶体属于离子晶体 |
| B.晶体的化学式为Ba2O2 |
| C.该晶体晶胞结构与NaCl相似 |
| D.与每个Ba2+距离相等且最近的Ba2+共有12个 |
甲、乙是由短周期元素组成的常见物质或微粒,在中学化学中有许多物质或微粒能满足下列相互转化关系: 下列说法不正确的是
下列说法不正确的是
| A.若乙为无色无味气体,则甲可能是CO32- |
| B.若甲是具有刺激性气味的气体,则甲、乙具有相同的电子数 |
| C.若甲、乙均为离子,甲、乙两种离子在同一溶液中一定不能大量共存 |
| D.甲有可能是AlO2-也有可能是Al(OH)3 |
下列推论正确的
| A.SiH4的沸点高于CH4,可推测PH3的沸点高于NH3 |
| B.NH4+为正四面体结构,可推测出PH4+也为正四面体结构 |
| C.Si晶体是原子晶体,可推测由C所形成的晶体也是原子晶体 |
| D.NaCl是离子化合物,可推测AlCl3也是离子化合物 |
甲、乙两种非金属,能说明甲比乙的非金属性强的是
①甲比乙容易与H2化合 ②甲单质能与乙阴离子发生置换反应 ③甲的最高价氧化物对应的水化物酸性比乙的最高价氧化物对应的水化物酸性强 ④与某金属反应时,甲原子得电子数目比乙的多 ⑤甲的单质熔、沸点比乙的低 ⑥甲元素的气态氢化物的水溶液酸性比乙元素的气态氢化物的水溶液酸性强
| A.①②③⑥ | B.②③④ | C.①②③ | D.①②③④ |
元素在周期表中的位置,反映了元素的原子结构和元素的性质。下列说法正确的是
| A.同一元素不可能既表现金属性,又表现非金属性 |
| B.第三周期元素的最高正化合价等于它所处的主族序数 |
| C.短周期元素形成离子后,最外层都达到8电子稳定结构 |
| D.同一主族的元素的原子,最外层电子数相同,化学性质完全相同 |
依据元素周期表及元素周期律,下列推断正确的是
| A.同主族元素从上到下,单质的熔点逐渐降低 |
| B.同周期元素(除0族元素外)从左到右,原子半径逐渐减小 |
| C.第ⅦA元素从上到下,其氢化物的稳定性逐渐增强 |
| D.若M+和R2-的核外电子层结构相同,则原子序数:R>M |