纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
| 方法Ⅰ |
用炭粉在高温条件下还原CuO |
| 方法Ⅱ |
电解法:2Cu+H2O 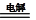 Cu2O+H2↑ Cu2O+H2↑ |
| 方法Ⅲ |
用肼(N2H4)还原新制Cu(OH)2 |
(1)工业上常用方法Ⅱ和方法Ⅲ制取Cu2O而很少用方法Ⅰ,其原因是反应条件不易控制,若控温不当易生成 而使Cu2O产率降低。
(2)已知:C(s)+O2(g)=CO2(g) △H=akJ·mol—1;
2CO(g)+O2(g)=2CO2(g) △H=bkJ·mol—1;
2Cu2O(s)+O2(g)=4CuO(s) △H=ckJ·mol—1.
方法Ⅰ制备过程会产生有毒气体,写出制备反应的热化学方程式 。
(3)方法Ⅱ采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示,该电池的阳极生成Cu2O反应式为 。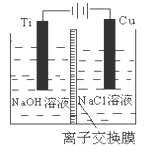
(4)方法Ⅲ为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2。该制法的化学方程式为 。
(5)方法Ⅲ可以用甲醛稀溶液替代肼,但因反应温度较高而使部分产品颗粒过大, (填操作名称)可分离出颗粒过大的Cu2O。
(6)在相同的密闭容器中,用方法Ⅱ和方法Ⅲ制得的Cu2O分别进行催化分解水的实验:
2H2O(g)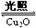 2H2(g)+O2(g) ⊿H >0
2H2(g)+O2(g) ⊿H >0
水蒸气的浓度(mol·L-1)随时间t (min)变化如下表:
| 序号 |
温度 |
0 |
10 |
20 |
30 |
40 |
50 |
| ① |
T1 |
0.050 |
0.0492 |
0.0486 |
0.0482 |
0.0480 |
0.0480 |
| ② |
T1 |
0.050 |
0.0488 |
0.0484 |
0.0480 |
0.0480 |
0.0480 |
| ③ |
T2 |
0.10 |
0.094 |
0.090 |
0.090 |
0.090 |
0.090 |
可以判断:实验①的前20 min的平均反应速率 ν(O2)= ;实验温度T1 T2(填“>”、“<”);催化剂的催化效率:实验① 实验②(填“>”、“<”)。
A、B、C、D、G都是含有同一种短周期元素的化合物,E是氧化物,H是单质。根据下图转化关系(反应条件及部分产物已略去)填空: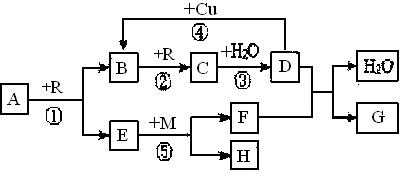
(1)若A、B、C、D、G 均含X元素,且A的一个分子中只含有10个电子,G是复合肥料,则反应①、②、③是工业生产的基本原理,M的化学式为;其中反应①的化学方程式为;反应④的离子方程式为;
(2)若A、B、C、D、G均含Y元素,Y元素处于X的相邻周期、相邻族,G可作净水剂,则反应①、②、③均是工业生产的基本原理,M形成的晶体类型为;其中反应①的化学方程式为;反应⑤的化学方程式为。
惕各酸苯乙酯(C13H16O2)广泛用作香精的调香剂。为了合成该物质,某实验室的科技人员设计了下列合成路线:
试回答下列问题:
(1)A的结构简式为;F的结构简式为。
(2)反应②中另加的试剂是;反应⑤的一般条件是。
(3)反应③的化学方程式为。
(4)上述合成路线中属于取代反应的是(填编号)。
I.下面a~e是中学化学实验中常见的几种定量仪器:
a.量筒 b.容量瓶 c.滴定管 d.托盘天平 e.温度计
①使用容量瓶的第一步操作是___________________________________。
②若用上述仪器配制500mL 2mol·L-1的NaCl溶液,还缺少的玻璃仪器是_________。
③若用上述仪器测定中和热,则缺少的玻璃仪器为烧杯、__________。
④若用上述仪器进行中和滴定,则缺少的仪器是__________。
Ⅱ某化学兴趣小组用含有铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体和胆矾晶体,以探索工业废料的再利用。其实验方案如下: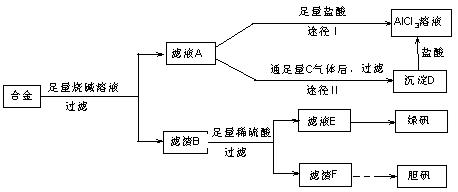
试回答下列问题:
(1)用的器材已有:滤纸、铁架台、铁圈和烧杯,还要补充的玻璃仪器是
。
(2)由滤液A制得AlCl3溶液有途径Ⅰ和Ⅱ两条,你认为合理的是,理由是 。
。
(3)从滤液E中得到绿矾晶体的实验操作是。
(4)写出用滤渣F制备胆矾晶体的有关化学方程式
。
(5)有同学提出可将方案中最初溶解合金的烧碱改用盐酸,重新设计方案,也能制得三种物质,你认为后者的方案是否更合理,理由是
。
某芳香烃A,分子式为C8H10;某烃类衍生物X,分子式为C15H14O3,能使FeCl3溶液显紫色:J分子内有两个互为对位的取代基,在一定条件下有如下的转化关系:(无机物略去)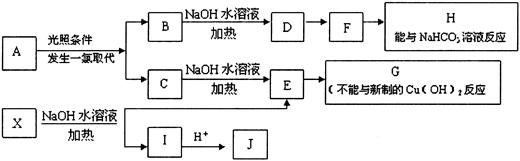
(1)属于芳香烃类的A的同分异构体中,其沸点的大小关系为____________________。(不包括A,用结构简式表示)
(2)J中所含的含氧官能团的名称为____________________。
(3)E与H反应的化学方程式是_______________;反应类型是__________。
(4)B、C的混合物在NaOH乙醇溶液中加热可以生成同一种有机物M,以M为单体合成的高分子化合物的名称是__________。
(5)已知J有多种同分异构体,写出一种符合下列性质的J的同分异构体的结构简式。
①与FeCl3溶液作用显紫色;②与新制Cu(OH)2悬浊液作用产生红色沉淀;③苯环上的一卤代物有2种。
_______________________________________
在一定条件下,经不同的化学反应,可实现如下图的各种变化。其中只有反应①、②属非氧化还原反应。X、Y为单质,其余为化合物,B是直线型分子,⑤是化学工业上的重要反应。据此请填空: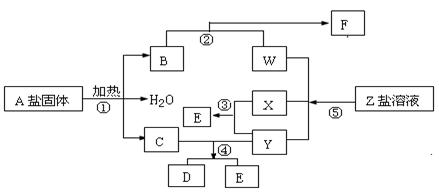
(1)写出下列物质的化学式:
A:X:Y:。
(2)写出反应②的离子方程式:。
(3)1 g X与Y完全反应放热91.5 kJ,反应③的热化学方程式
。
(4)反应④中C与Y的物质的量之比为1:3,D中只含两种元素,则D是。