银氨溶液可用于检测CO气体,实验室研究的装置如图:
 |
已知:银氨溶液制备反应为 Ag++2NH3·H2O=[Ag(NH3)2]++2H2O。 反应结束后试管C底部有黑色沉淀生成,分离出上层清液和底部黑色固体备用。 |
(1)甲酸(HCOOH)遇浓硫酸分解生成CO和H2O,该反应体现浓硫酸的 (填“强氧化性”或“脱水性”)。
(2)装置A中软管的作用是 。
(3)为验证上层清液中产物的成分,进行如下实验:
a.测得上层清液pH为10。
b.向上层清液中滴加几滴Ba(OH)2溶液,发现有白色浑浊出现,同时产生能使湿润红色石蕊试纸变蓝的气体。
c.取新制的银氨溶液滴加几滴Ba(OH)2溶液,无明显现象。
①实验c的目的是 。
②根据上述实验现象判断,上层清液中产物成分为 (填化学符号)。
(4)设计实验证明黑色固体的成分是Ag:
可供选择的试剂有:浓硫酸、浓硝酸、NaOH溶液、NaCl溶液。
取少量上述黑色固体,用蒸馏水洗净, ,说明黑色固体是Ag单质。(补充必要的实验内容及实验现象)
(5)从银氨溶液中回收银的方法是:向银氨溶液中加入过量盐酸,过滤,向沉淀AgCl中加入羟氨(NH2OH),充分反应后可得银,羟氨被氧化为N2。
①写出生成AgCl沉淀的离子反应 。
②若该反应中消耗6.6 g羟氨,理论上可得银的质量为 g。
实验探究:探究碳、硅元素的非金属性的相对强弱
根据要求完成下列各小题
(1)实验装置: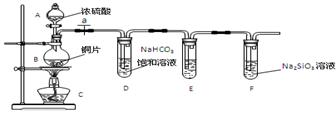
填写所示仪器名称AB
(2)实验步骤:
连接仪器、、加药品后,打开a、然后滴入浓硫酸,加热
(3)问题探究:(已知酸性强弱:亚硫酸 >碳酸)
①铜与浓硫酸反应的化学方程式是;装置E中足量酸性KMnO4溶液的作用是;
②能说明碳元素的非金属性比硅元素非金属性强的实验现象是;
③依据试管D中的实验现象,能否证明硫元素的非金属性强于碳元素的非金属性(填“能”或“否”),试管D中发生反应的离子方程式是
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液。
已知:①无水氯化钙可与乙醇形成难溶于水的CaCl2·6C2H5OH
②有关有机物的沸点:
| 试剂 |
乙醚 |
乙醇 |
乙酸 |
乙酸乙酯 |
| 沸点/ ℃ |
34.7 |
78.5 |
118 |
77.1 |
| 试剂 |
乙醚 |
乙醇 |
乙酸 |
乙酸乙酯 |
| 沸点/℃ |
34.7 |
78.5 |
118 |
77.1 |
请回答:
(1)浓硫酸的作用是;若用同位素18O示踪法确定反应产物水分子中氧原子的提供者,写出能表示18O位置的化学方程式:。
球形干燥管C的作用是。若反应前向D中加入几滴酚酞,溶液呈红色,产生此现象的原因是(用离子方程式表示);反应结束后D中的现象是。
(3)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出。
某化学兴趣小组欲设计使用如下装置验证:铜和一定量的浓硝酸反应有一氧化氮产生。(假设气体体积均为标准状况,导气管中气体体积忽略不计,且忽略反应中溶液的体积变化)试回答下列问题:
(1)在铜和浓硝酸反应前,挤压打气球,经A、B、C三个装置后,进入装置D中的气体是(填化学式),通入该气体的目的是;进行此步操作时应关闭(填“K1”“K2”或“K3”,下同),打开。
(2)若装置C的硬质玻璃管中出现堵塞,则装置B中可能出现的现象是。
(3)关闭K1、K2,打开K3,由分液漏斗向装置D的试管中滴加浓硝酸。待Cu和浓硝酸反应结束后,再通过分液漏斗向装置D的试管中加入CCl4至满。则装置D的试管中一定发生的离子反应方程式为。
(4)从装置E所得溶液中取出25.00 mL,用0.1000 mol/L的NaOH溶液进行中和,当恰好呈中性时消耗NaOH溶液18.00mL ,则装置E中所得硝酸的物质的量浓度为。
(5)实验前量气管的液面读数为368.50 mL,实验后量气管的液面读数为224.00 mL。则上述铜和一定量的浓硝酸反应中(填“有”或“无”)NO生成,写出推导过程。
铁、铝与冷浓硫酸可发生钝化现象,故工业上常用铁质容器盛装冷浓硫酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
[探究一]
(1)将已去除表面氧化物的铁钉(碳素钢)m g放入稀硫酸中,铁钉表面现象为。取出铁钉用蒸馏水洗涤后干燥,置于冷浓硫酸中,10分钟后移入稀硫酸溶液中,观察,开始一段时间铁钉表面无明显变化,其原因是。
(2)另称取铁钉放入足量冷浓硫酸中,加热,充分反应后,过滤得到、溶液X并收集到气体Y。
①甲同学认为X中除铁单质外外还可能含有Fe3+、Fe2+。若要确认其中的Fe2+,可选择试剂为_________________,现象是_______________________________________________。
②乙同学根据氧化还原反应原理,认为气体中必然含有SO2,取336ml(标准状况)气体Y通入足量溴水中,发生反应离子方程式为:________________________________________。
然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33g。由于此推知气体Y中SO2的体积分数为。
[探究二]
分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含量有H2和Q气体。为此设计了下列探究实验状置(图中夹持仪器省略)加以验证。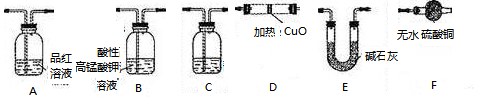
(3)装置的连接顺序是________________________________。
(4)除了C中的现象证明Q存在为,认为气体Y中还含有Q的理由是(用化学方程式表示)。
(5)混合气体可能由H2、Q、SO2中的一种或多种气体组成,经测定其含氧量为50%,则该气体可能:①仅由SO2组成;②由H2和Q组成;③由H2和SO2组成;④由Q、SO2组成;⑤由H2、Q和SO2组成;其中可能正确的有( )
| A.① | B.②③④ | C.①②⑤ | D.③④⑤ |
某学生对SO2与漂粉精的反应进行实验探究:
| 操作 |
现象 |
| 取适量漂粉精固体,加入100mL水 |
部分固体溶解,溶液略有颜色 |
| 过滤,测漂粉精溶液的pH |
pH试纸先变蓝,后褪色 |
 |
液面上方出现白雾; 稍后,出现浑浊,溶液变为黄绿色; 稍后,产生大量白色沉淀,黄绿色褪去 |
(1)写出C12和Ca(OH)2制取漂粉精的化学方程式;
(2)向水中持续通入SO2,未观察到白雾。推测现象i的白雾由HCl小液滴形成,进行如下实验:
a.用湿润的碘化钾淀粉试纸检验白雾,无变化;
b.用酸化的AgNO3溶液检验白雾,产生白色沉淀。
①实验a目的是;
②由实验a、b不能判断白雾中含有HC1,理由是;
(3)将A瓶中混合物过滤、洗涤,得到沉淀X
①向沉淀X中加入稀HC1,无明显变化。取上层清液,加入BaC12溶液,产生白色沉淀。则沉淀X中含有的物质是;
②用离子方程式解释现象iii中黄绿色褪去的原因:。
(4)测定漂粉精有效成分的质量分数。称取2.000 g漂粉精于锥形瓶中,加水溶解,调节溶液的pH,以淀粉为指示剂,用0.2000 mol·L-1 KI溶液进行滴定,溶液出现稳定浅蓝色时为滴定终点。反应原理为:3C1O-+ I- ="=" 3C1-+ IO3-
IO3- + 5I-+ 3H2O ="=" 6OH-+ 3I2
实验测得数据如下表所示。
| 滴定次数 |
1 |
2 |
3 |
| KI溶液体积/mL |
19.98 |
20.02 |
20.00 |
该漂白粉中有效成分的质量分数为。