氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为MgCO3,含少量FeCO3 )为原料制备高纯氧化镁的实验流程如下:
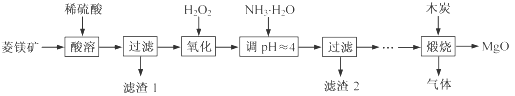
(1)MgCO3与稀硫酸反应的离子方程式为 。
(2)加入H2O2氧化时,发生反应的化学方程式为 。
(3)滤渣2 的成分是 (填化学式)。
(4)煅烧过程存在以下反应:
2MgSO4+C 2MgO+2SO2↑+CO2↑
2MgO+2SO2↑+CO2↑
MgSO4+C MgO+SO2↑+CO↑
MgO+SO2↑+CO↑
MgSO4+3C MgO+S↑+3CO↑
MgO+S↑+3CO↑
利用右图装置对煅烧产生的气体进行分步检验或收集。

①D中收集的气体可以是 (填化学式)。
②B中盛放的溶液可以是 (填字母)。
a.NaOH 溶液 b.Na2CO3溶液 c.稀硝酸 d.KMnO4溶液
③A中得到的淡黄色固体与热的NaOH溶液反应,产物中元素最高价态为+4,写出该反应的离子方程式: 。
( 12分) “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯。回答下列问题:
(1)写出 制取乙酸乙酯的化学反应方程式
制取乙酸乙酯的化学反应方程式
(2)在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合液,通常的顺序是:
。
(3)浓硫酸的作用是:;。
(4)饱和碳酸钠溶液的主要作用是。
(5)若要把制得的乙酸乙酯分离出来,应采用的实验操作是 。
(6)生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应 的限度,也即达到化学平衡状态。下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有(填序号) 。
的限度,也即达到化学平衡状态。下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有(填序号) 。
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸④正反应的速率与逆反应的速率相等⑤混合物中各物质的浓度不再变化
有关催化剂的催化机理问题我们可以从“乙醇催化实验”中得到一些认识。某教师设计了下图所示装置(夹持装置已省略),试回答下列问题: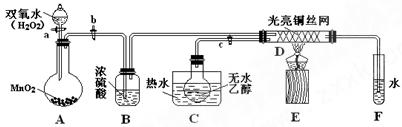
(1)A中发生反应的化学方程式为:___________________________;
(2)反应一段时间后,若移去酒精灯反应仍能继续进行,则说明该乙醇的氧化反应是_________________(填“发热”或“吸热”)反应;
(3)实验过程中D处铜丝网有红色和黑色交替出现的现象,请用化学方程式解释原因。现象①:红色变黑 色:___________________________________________;
色:___________________________________________;
现象②:黑色变红色:____________________________________________
从这些实验现象中可以认识到实验过程中催化剂__________(填“参加”或“不参加”)化学反应。
(4)装置B、F的作用分别是
B:______________________________________,
F:_________________________________。
农民使用的氮肥主要是“氢铵”和尿素。某化学兴趣小组对某“氢铵”化肥进行了专项研究:
(1)[预测]根据已有知识预测该“氢铵”是碳酸或亚硫酸或硫酸的铵盐。
(2)[验证和探究]①NH+4的验证:取少量固体药品于试管中,然后。(填写试剂和操作)
②阴离子的探究:a.取少量固体药品于试管中,然后向试管中滴加稀盐酸,固体全部溶解,将产生的气体通人下图装置。观察到的现象是:溴水无明显变化,澄清石灰水变浑浊。再向滴加稀盐酸反应后的试管中,加Ba(OH)2溶液,无明显现象。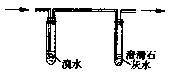
初步结论:“氢铵”是的铵盐。
b.要进一步确定“氢铵”的成分还需要补做如下实验:取适量“氢铵”配制成溶液,取试液于一支洁净的试管中,加入。(填写试剂和操作)
(3)[解释与评价]该实验小组设计了以下两个实验方案测定该化肥的含氮量,请你阅读后解释方案中提出的问题并进行评价方案(一):准确称取一定质量的样品mg,放入图案(一)的烧瓶中,滴加过量NaOH浓溶液,充分微热,通过实验测定烧杯增加的质量为m1g。
方案(二):准确称取一定质量的样品mg,放入图方案(二)的烧瓶中,滴加过量NaOH浓溶液,充分微热,按如图装置测量生成的氨气体积为VL(标况)。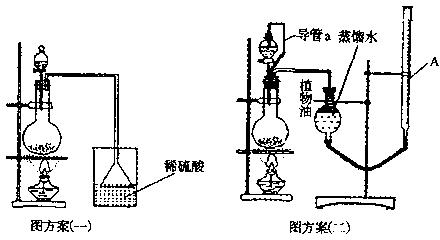
①方案(二)图中导管a的作用是。
②请你评价上述两套方案是否合理。若合理写出计算式;若不合理,请简要说明原因。
方案(一):。
方案(二):。
某化学课外兴趣小组为探究苯与液溴之间的反应,进行实验(装置如下图所示)。请根据要求回答相关问题。(已知苯的沸点为80.1 ℃,密度为0.9 g/mL )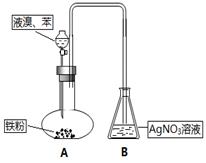
(1)写出苯与液溴反应的化学方程式反应类型为___________。
(2)锥形瓶中有淡黄色浑浊生成,该组同学经过讨论后认为,依据该现象不能确定发生了以上反应,理由是:,因此有必要对实验进行改进。
(3)请依据下面的实验流程图选取合适的装置和试剂对上述实验进行改进: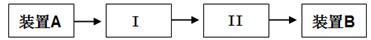
I ________________ , II ___________________
| A.装有NaOH溶液的洗气瓶 | B.装有CC14的洗气瓶 |
| C.装有KI溶液的洗气瓶 | D.装有湿润淀粉KI试纸的集气瓶 |
①小组同学对改进实验后的B装置中产生的淡黄色沉淀,进行过滤、洗涤、干燥、称量。在 以上步骤中:验证沉淀已洗涤干净的方法是_______________________________________。
以上步骤中:验证沉淀已洗涤干净的方法是_______________________________________。
②若实验中取用的苯为17.3 mL,液溴为足量,最终测得的沉淀质量为18.8 g,则苯在该反应中的转化率为 ________________,该组同学认为转化率过低,除了可能发生副反应和反应可能进行不完全外,你分析还可能的原因是______________________________________,___________________________________________(请答出2条)
(Ⅰ)本世纪是生命科学研究的昌盛时期, 科学家研究发现,进入生物体内的氧分子,可接受1个电子转变为超氧阴离子自由基(O2-),进而引发产生一系列自由基。一切需氧生物在其机体内均有一套完整的活性氧系统(抗氧化酶和抗氧化剂),能将活性氧转变为活性较低的物质,机体因此受到保护。人们利用羟胺(NH2OH)氧化的方法可以检测其生物系统中O2-含量,原理是O2-与羟胺反应生成NO2-和一种过氧化物。NO2-在对氨基苯磺酸和α-萘胺作用下,生成粉红的偶氮染体,染体在波长530nm处有显著吸收,且其吸收值与c(NO2-)成正比,从而可计算出样品中的O2-含量。某实验室用以上方法处理后测得溶液中c(NO2-)=2.500×10-3 mol∙L-1。
科学家研究发现,进入生物体内的氧分子,可接受1个电子转变为超氧阴离子自由基(O2-),进而引发产生一系列自由基。一切需氧生物在其机体内均有一套完整的活性氧系统(抗氧化酶和抗氧化剂),能将活性氧转变为活性较低的物质,机体因此受到保护。人们利用羟胺(NH2OH)氧化的方法可以检测其生物系统中O2-含量,原理是O2-与羟胺反应生成NO2-和一种过氧化物。NO2-在对氨基苯磺酸和α-萘胺作用下,生成粉红的偶氮染体,染体在波长530nm处有显著吸收,且其吸收值与c(NO2-)成正比,从而可计算出样品中的O2-含量。某实验室用以上方法处理后测得溶液中c(NO2-)=2.500×10-3 mol∙L-1。
⑴ 请根据测定原理写出有关反应的离子方程式 ▲;
⑵ 计算该样品此时c(O2-) = ▲;
⑶ 如用羟胺氧化法测定O2-时,将其生成的过氧化物作为检测物,若选用氧化还原法进行定量分析(用KMnO4标准溶液进行滴定)
① 请写出其测定原理的反应方程式 ▲;
② 测定所用的主要玻璃仪器为 ▲,通过观察 ▲的现象可确定测定反应是否进行完全。
(Ⅱ)水中的NO2-是含氮有机物分解的产物,其浓度的大小是水源污染的标志之一。检测水中的NO2-可用比色法,其步骤是:
a. 配制标准溶液:称取0.30gNaNO2,溶于水后在容量瓶中稀释至1L得溶液A,移取5mL溶液A,稀释至1L,得溶液B。
b. 配制标准色阶:取6只规格为10mL的比色管(即质地、大小、厚薄相同且具塞的平
底试管),分别加入体积不等的溶液B,并稀释至10mL,再加入少许(约0.3g)对苯磺酸粉末,实验结果如下表所示:
| 色阶序号 |
1 |
2 |
3 |
4 |
5 |
6 |
| 加入溶液B的体积(mL) |
0 |
2.0 |
4.0 |
6.0 |
8.0 |
10.0 |
| 反应后溶液颜色 |
由无色变为由浅到深的樱桃红色 |
c. 检测:取10mL水样倒入比色管中,加少许对氨基苯磺酸,显色后与标准色阶对比。请填写以下空白:
① 比色法的基本依据是 ▲;
② 若水样显色后与色阶中的5号颜色相同,则表明水样中NO2-含量为 ▲mg/L。
③ 用NaNO2直接配制溶液B的缺点是 ▲。
④ 如果水样显色后比6号还深,应采取的措施是 ▲。