有机物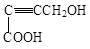 是重要的化工原料,其合成过程如下:
是重要的化工原料,其合成过程如下:
(1)化合物II的分子式为 ,Ⅳ中含氧官能团的名称是 ,反应①的反应类型是 反应。
(2)化合物I~IV具有的性质正确的是 。
| A.1mol化合物II最多能与2molH2发生加成反应 |
| B.1mol化合物II燃烧最多消耗8.5molO2 |
| C.1mol化合物IV能与2mol金属钠、1molNaHCO3反应产生气体 |
| D.化合物I和IV在一定条件下都能与乙酸发生酯化反应 |
(3)芳香化合物V是II的一种无甲基同分异构体,能使FeCl3溶液显紫色,则V的结构简式为 、 、 。
(4)一定条件下,化合物Ⅳ能形成缩聚高分子,该有机高分子的结构简式为 。
(5)有机物VI(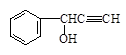 )与
)与 发生反应的方程式为 。
发生反应的方程式为 。
化学反应原理在科研和生产中有广泛应用。
Ⅰ、如图装置所示,A、B中的电极为多孔的惰性电极;C、D为夹在浸有Na2SO4溶液的滤纸条上的铂夹;电源有a、b两极。若A、B中充满KOH溶液后倒立于KOH溶液的水槽中。切断K1,闭合K2、K3通直流电。
回答下列问题:
(1) a是电源的极,写出A中的电极反应式为_____。
(2)湿的Na2SO4滤纸条上能观察到的现象有____________。
(3)电解一段时间后,A、B中均有气体包围电极,若此时切断K2、K3,闭合K1,发现电流表的指针移动,写出此时B中的电极反应式为。
Ⅱ、甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上一般采用下列反应合成甲醇:CO(g)+2H2(g)  CH3OH(g) ΔH,下表所列数据是该反应在不同温度下的化学平衡常数(K)。请回答下列问题:
CH3OH(g) ΔH,下表所列数据是该反应在不同温度下的化学平衡常数(K)。请回答下列问题:
| 温度 |
250℃ |
300℃ |
350℃ |
| K |
2.041 |
0.270 |
0.012 |
(4)由表中数据判断ΔH0(填“>”、“<”或“=”)。
(5)其他条件不变,只改变其中一个条件,下列措施可提高甲醇产率的是。
A.升高温度;B.使用合适的催化剂;C.缩小容器的容积;D.充入过量的H2;E.恒压时,充入He;F.从体系中分离出CH3OH
(6)某温度下,将2mol CO和6 mol H2充入2L密闭容器中,反应进行到4min末达到平衡,此时测得c(CO) =0.2 mol/L ,则0~4min内H2的反应速率为;若保持温度容积不变再向其中充入一定量的CH3OH,重新达到化学平衡状态,与原平衡状态相比,此时平衡混合气体中CH3OH的体积分数(填“变大”、“变小”、或“不变”)。
A~F均为元素周期表中前四周期元素,其相关信息如下表:
| 元素 |
相关信息 |
| A |
A的基态原子最外层电子排布式为2s22p3 |
| B |
B是地壳中含量最高的元素 |
| C |
C+与B的简单离子的电子层结构相同 |
| D |
D的一种核素的质量数为64,中子数为35 |
| E 、F |
E 、F既同周期又同族,且原子序数F比E多2 |
请回答下列问题:
(1)D的价电子的电子排布式是;F原子的原子结构示意图为。
(2)A、B的第一电离能的大小顺序为 。
(3)AB3-中A原子的杂化轨道类型为_______;与A2B互为等电子体的分子的分子式为(任写一个即可)。
(4)D晶体的晶胞如图所示为面心立方最密堆积 (在晶胞的顶点和面心均含有一个D原子)。则D的晶体中D原子的配位数为。
(5)已知17gA的简单氢化物催化氧化生成气态水时放出QkJ的热量,请写出A的简单氢化物催化氧化的热化学反应方程式。
(6)C2B2的电子式为____;它可与E的二氯化物溶液反应,若反应的C2B2与E的二氯化物的物质的量之比为1:2,则该反应的化学反应方程式为。
研究物质间的氧化还原反应有重要的意义。
(1)一定条件下Fe(OH)3与KClO在KOH溶液中反应可制得K2FeO4,其中反应的氧化剂是___________;生成0.5molK2FeO4转移电子的物质的量____________mol。
(2)高铁电池是一种新型二次电池,电解液为碱溶液,其反应式为:
3Zn(OH)2+2Fe(OH)3+4KOH 3Zn+2K2FeO4+8H2O
3Zn+2K2FeO4+8H2O
放电时,电池的负极反应式为____________。充电时电解液的pH____________(填“增大”“不变”或“减小”)
(3)H2O2是一种绿色氧化剂。工业制备H2O2的原理如下:
①电解池总反应:2S2O42−+2H+═S2O82-+H2↑
②电解生成的S2O82-水解:S2O82-+2H2O═H2O2+2H++SO42−
电解池中阴极反应式____________。
A、B、C为3种单质(其中A为固体,B、C为气体),将D的饱和溶液滴入沸水中继续煮沸,溶液呈红褐色,B、C反应的产物易溶于水得到无色溶液E。它们之间的转化关系如下图: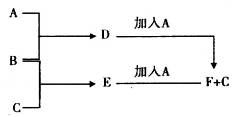
填写下列空白:
(1)物质A是____________,物质B是___________,B元素的离子结构示意图为___________。
(2)写出化合物E的电子式:____________,D的饱和溶液滴入沸水中溶液呈红褐色的原因是(用离子方程式表示):_______________________________,D溶液可以用来止血。
(3)工业上把B单质与石灰乳反应可制得漂白粉,漂白粉的有效成份是_______,漂白粉常用于自来水的杀菌消毒,原因是:(用化学方程式和适当的文字说明)______________________。
(4)F中加入NaOH溶液,并在空气中放置,沉淀由白色变为灰绿色最后变成红褐色的化学方程式是_____________________________________。
I.已知:反应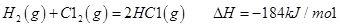
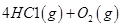
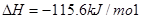
请回答: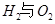 反应生成气态水的热化学方程式__________________________
反应生成气态水的热化学方程式__________________________
II.实施以减少能源浪费和降低废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择。化工业的发展必须符合国家节能减排的总体要求。试运用所学知识,解决下列问题:
(1)已知某反应的平衡表达式为: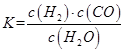
它所对应的化学方程式为:_________________________________________________
(2)已知在400℃时,反应
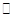
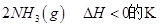 =0.5,则400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应
=0.5,则400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应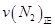 ____________
____________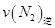 (填:>、<、=、不能确定);
(填:>、<、=、不能确定);
欲使得该反应的化学反应速率加快,同时使平衡时NH3的体积分数增加,
可采取的正确措施是____________(填序号)
A.加催化剂 B.升高温度 C.缩小体积增大压强 D.使氨气液化移走
(3)在一定体积的密闭容器中,进行如下化学反应: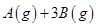
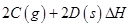 ,其化学平衡常数K与温度T的关系如下表:
,其化学平衡常数K与温度T的关系如下表:
请完成下列问题:
①判断该反应的 ___________0(填“>”或“<”)
___________0(填“>”或“<”)
②在一定条件下,能判断该反应一定达化学平衡状态的是___________(填序号)。
A.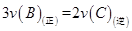 B.容器内压强保持不变
B.容器内压强保持不变
C.A和B的转化率相等 D.混合气体的密度保持不变