某校课外小组模拟工业制备纯碱并测定纯碱的纯度,甲、乙两组同学分别进行了下列相关实验。
(1)已知碳酸氢钠受热分解生成碳酸钠、水和CO2,由碳酸氢钠制备纯碱的过程中用到的主要仪器除酒精灯、泥三角、三脚架、玻璃棒外,还有__________________。
(2)甲组同学利用以下装置制备碳酸氢钠:
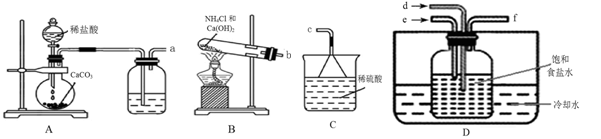
①图中装置的连接方法为a接 ,b接 ,f接c。
②装置D中试剂瓶内发生的化学反应方程式为 。
③实验中要求通入的NH3过量之后再通入CO2气体,检验通入的NH3已过量的实验操作是 。
(3)已知实验中得到的Na2CO3中常含有少量NaCl。乙组设计如下图所示装置来测定Na2CO3的含量。

①检验装置F气密性的方法是:塞紧带长颈漏斗的三孔橡胶塞,夹紧弹簧夹后,从漏斗注入一定量的水,使漏斗内的水面高于瓶内的水面,停止加水后静置,若 ,说明装置不漏气。
②装置E中的试剂 ,装置G的作用 。
③以上实验装置存在明显缺陷,该缺陷导致测定结果偏高,该缺陷为 。
(2014届北京市西城区高三4月一模考试理综化学试卷)
某小组对Cu与浓HNO3的反应进行研究。记录如下: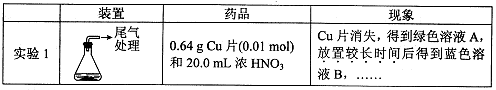
I.Cu与浓HN03反应的化学方程式是 。
II.探究实验1中溶液A呈绿色而不是蓝色的原因。
(1)甲认为溶液呈绿色是由Cu2+离子浓度较大引起的。乙根据实验记录,认为此观点不正确,乙的依据是 。
(2)乙认为溶液呈绿色是由溶解的NO2引起的。进行实验2:先将NO2通入B中,再鼓入N2。结果证实假设成立。则以上两步操作对应的现象分别是 、 。
(3)为深入研究,丙查阅资料,有如下信息:
i.溶有NO2的、浓HNO3呈黄色;水或稀HNO3中通少量NO2溶液呈无色。
ii.NO2溶于水,会发生反应2NO2+H2O =HNO3+HNO2HNO2是弱酸,只能稳定存在于冷、稀的溶液中,否则易分解。
iii.NO—2能与Cu2+反应:Cu2+(蓝色)+4 NO2-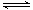 Cu(NO2)42-(绿色)
Cu(NO2)42-(绿色)
据此,丙进一步假设:
①可能是A中剩余的浓HNO3溶解了NO2得到的黄色溶液与Cu(NO3)2的蓝色溶液混合而形成的绿色;
②可能是A中生成了Cu(NO2)2—4使溶液呈绿色。
丙进行如下实验:
①亚硝酸分解的化学方程式是 。
②请用平衡原理解释加入稀H2SO4后绿色溶液变蓝的原因: 。
(4)根据实验得出结论:实验l中溶液A呈绿色的主要原因是 ,请依据实验现象阐述理由: 。
(2014届河南省商丘市高三第二次模拟考试理综化学试卷)
某研究性学习小组用下列装置(铁架台等支撑仪器略)探究氧化铁与乙醇的反应,并检验反应产物。
(1)为快速得到乙醇气体,可采取的方法是 ;
若实验时小试管中的溶液已经开始发生倒吸,你采取的措施是 (填写编号);
a.取下小试管 b.移去酒精灯 c.将导管从乳胶管中取下 d.以上都可以
(2)盛Cu(OH)2悬浊液的试管中出现的现象为 。
(3)如图实验,观察到红色的Fe2O3全部变为黑色固体(M),充分反应后停止加热。为了检验M的组成,进行下列实验。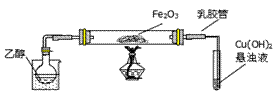
①M能被磁铁吸引;加入足量稀硫酸,振荡,固体全部溶解,未观察到有气体生成;
② 经检验溶液中有Fe2+和Fe3+,检验该溶液中的Fe2+的方法是 ;
关于M中铁元素价态的判断正确的是 (填写编号)。
a.一定有+3价和+2价铁,无0价铁
b.一定有+3价、+2价和0价铁
c.一定有+3价和0价铁,无+2价铁
d.一定有+3和+2价铁,可能有0价铁
(4)若M的成份可表达为FeXOY,用CO还原法定量测定其化学组成。称取a g M样品进行定量测定,实验装置和步骤如下: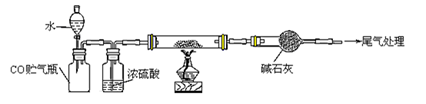
①组装仪器;②点燃酒精灯;③加入试剂; ④打开分液漏斗活塞;⑤检查气密性;⑥停止加热;⑦关闭分液漏斗活塞;⑧……。正确的操作顺序是 (填写编号)
a.①⑤④③②⑥⑦⑧ b.①③⑤④②⑦⑥⑧ c.①⑤③④②⑥⑦⑧ d.①③⑤②④⑥⑦⑧
(5)若实验中每步反应都进行完全,反应后M样品质量减小b g,则FexOy中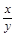 = 。
= 。
(2014届浙江省杭州市杭州学军中学高三第二次月考化学试卷)
某学生对SO2与漂粉精的反应进行实验探究:
| 操作 |
现象 |
| 取适量漂粉精固体,加入100mL水 |
部分固体溶解,溶液略有颜色 |
| 过滤,测漂粉精溶液的pH |
pH试纸先变蓝,后褪色 |
 |
液面上方出现白雾; 稍后,出现浑浊,溶液变为黄绿色; 稍后,产生大量白色沉淀,黄绿色褪去 |
(1)写出C12和Ca(OH)2制取漂粉精的化学方程式 ;
(2)向水中持续通入SO2,未观察到白雾。推测现象i的白雾由HCl小液滴形成,进行如下实验:
a.用湿润的碘化钾淀粉试纸检验白雾,无变化;
b.用酸化的AgNO3溶液检验白雾,产生白色沉淀。
①实验a目的是 ;
②由实验a、b不能判断白雾中含有HC1,理由是 ;
(3)将A瓶中混合物过滤、洗涤,得到沉淀X
①向沉淀X中加入稀HC1,无明显变化。取上层清液,加入BaC12溶液,产生白色沉淀。则沉淀X中含有的物质是 ;
②用离子方程式解释现象iii中黄绿色褪去的原因: 。
(4)测定漂粉精有效成分的质量分数。称取2.000 g漂粉精于锥形瓶中,加水溶解,调节溶液的pH,以淀粉为指示剂,用0.2000 mol·L-1 KI溶液进行滴定,溶液出现稳定浅蓝色时为滴定终点。反应原理为:3C1O-+ I- ="=" 3C1-+ IO3-
IO3- + 5I- + 3H2O ="=" 6OH-+ 3I2
实验测得数据如下表所示。
| 滴定次数 |
1 |
2 |
3 |
| KI溶液体积/mL |
19.98 |
20.02 |
20.00 |
该漂白粉中有效成分的质量分数为 。
(2014届北京市东城区普通校高三3月联考理综化学试卷)
下图为某套实验装置示意图,其中加热装置和部分药品等均已经省略(装置①和装置②为气体发生装置)。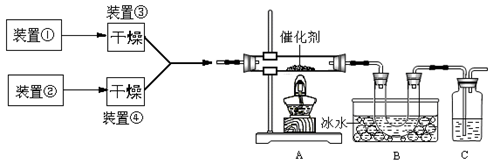
(1)甲同学用此装置(在A、B间增加一盛有浓硫酸的洗气瓶)制备NO2并验证其性质。装置①用于实验室制备NH3,用装置②制备过量O2。装置①中发生反应的化学方程式是 。B处冰水冷却的U型管中有红棕色气体生成且越接近U型管底部颜色越浅,请解释原因 。
(2)乙同学用此套装置合成SO3,B处冰水冷却的U型管中有固体出现。C中若盛放酸性K2Cr2O7溶液,则在C中发生的氧化还原反应的离子方程式是 (生成物中Cr以Cr3+形式存在);现欲制得纯净干燥的SO3,若C中盛放NaOH溶液,则此装置中存在明显不足,应如何改进 (从下面给出的实验装置中选择字母标号补充或替换,并用简要文字说明补充和替换的位置)。
(3)丙同学拟验证NO能被氨气还原并测算其转化率(装置①、装置②分别制NO和NH3),将上述装置A、B、C分别换成下列⑤、⑥、⑦。
请回答:装置⑦的作用可能是 ;若进入装置⑤的NO共22.4L(已折算为标准状况,下同),氨气过量,最后收集到标准状况下11.2LN2,则NO的转化率是 。
(2014届四川省资阳市4月高考模拟考试理综化学试卷)
Ⅰ、某小组同学将一定浓度NaHCO3溶液加入到CuSO4溶液中发现生成了沉淀。甲同学认为沉淀是CuCO3,乙同学认为沉淀是CuCO3和Cu(OH)2的混合物。他们设计实验通过测定沉淀中CuCO3的质量分数来确定沉淀的组成。
(1)按照甲同学的观点,发生反应的离子方程式为: 。
(2)两同学利用下图所示装置进行测定: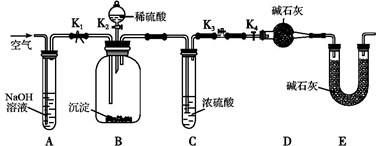
①在研究沉淀物组成前,须将沉淀从溶液中分离并净化。具体操作依次为_____、_____、干燥。
②装置E中碱石灰的作用是 。
③实验过程中有以下操作步骤:
a.关闭K2、K4,打开K1、K3,通入过量空气
b.关闭K1、K3,打开K2、K4,充分反应
c.关闭K2、K3,打开K1、K4,通入过量空气
若沉淀质量为m,C中浓硫酸增重x,D中碱石灰增重为y,则CuCO3的质量分数为______。若未进行步骤a,将使测量结果 。
Ⅱ、某同学设计右图所示装置(夹持装置略,气密性已检验),用废铁屑来制取FeCl3·6H2O晶体。其操作步骤如下:
①打开弹簧夹K1,关闭弹簧夹K2,并打开活塞a,缓慢滴加盐酸至过量。
②当……时,关闭弹簧夹K1,打开弹簧夹K2,当A中溶液完全进入烧杯后关闭活塞a。
③将烧杯中含有盐酸的溶液蒸发浓缩、冷却结晶、过滤后得到FeCl3·6H2O晶体。
请回答:
(1)步骤②中“……”的内容是_____。
(2)写出A中溶液进入烧杯后发生反应的离子方程式:____。
(3)步骤③烧杯中溶液里盐酸的作用是____。