(15分)常温下,某水溶液M中存在的离子有:Na+、A2-、HA-、H+、OH-,存在的分子有H2O、H2A。根据题意回答下列问题:
(1)写出酸H2A的电离方程式__________________________。
(2)若溶液M由10mL 2 mol•L-1NaHA溶液与2mol•L-1NaOH溶液等体积混合而得,则溶液M的pH ________7 (填“>”、“<”或“=”),溶液中离子浓度由大到小顺序为 。
(3)若溶液M由下列三种情况:①0.01mol•L-1的H2A溶液②0.01mol•L-1的NaHA溶液(常温下,其pH>7)③0.02mol•L-1的HCl与0.04mol•L-1的NaHA溶液等体积混合液,则三种情况的溶液中H2A分子浓度最大的为 ;pH由大到小的顺序为 。
(4)若溶液M由pH=3的H2A溶液V1 mL与pH=11的NaOH溶液V2 mL混合反应而得,混合溶液c(H+)/c(OH-)=104,V1与V2的大小关系为_________(填“大于、等于、小于”或“均有可能”)。
(5)已知Ksp(BaA)= 1.8×10-10,向⑵的混合溶液中加入10mL 1 mol•L-1 BaCl2溶液,混合后溶液中的Ba2+浓度为___________ mol•L-1。
常温下将一块钠露置在空气中一段时间后,甲、乙两位同学把固体分成两份,各取一份同时进行实验,欲探究其组成和含量。请根据要求回答下列问题。
甲 同学:将一份放入烧瓶中,加入稀硫酸后,生成无色无味的气体,据分析推理可能有二氧化碳和氢气,然后进行气体成份的验证实验。
同学:将一份放入烧瓶中,加入稀硫酸后,生成无色无味的气体,据分析推理可能有二氧化碳和氢气,然后进行气体成份的验证实验。
( 1)为验证气体产物中是否含有二氧化碳和氢气,需从下图中选择必要的仪器和药品,设计一套装置验证气体成份。装置的连接顺序为:d→→→→
1)为验证气体产物中是否含有二氧化碳和氢气,需从下图中选择必要的仪器和药品,设计一套装置验证气体成份。装置的连接顺序为:d→→→→
→→。(填下列装置的接口字母)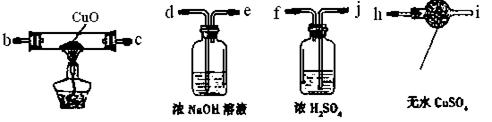
(2)实验过程中观察到石灰水变浑浊,由此可判断原固体中含有的物质是________
(填化学式)。
乙同学将另一份进行以下实验。
(3)用浓盐酸配制500mL 3.00mol·L-1的稀盐酸时,需要使用的玻璃仪器除了量筒、烧杯、胶头滴管、玻璃棒以外,还有。
(4)在操作II中,发生反应的离子方程式为。
(5)操作IV中用盐酸标准 液滴定滤液时,滴定终点的现象是。
液滴定滤液时,滴定终点的现象是。
(6)若操作IV中,消耗3.00mol·L-1的盐酸标准液50.00 mL,通过计算判断,5.00g固体中是否含有NaOH________(填有或无),质量是________g
(若你认为无NaOH,则此空不用答)。
硫酸工业中废渣称为硫酸渣,其成分为SiO2、Fe2O3、Al2O3、MgO。某探究性学习小组的同学设计以下方案,进行硫酸渣中金属元素的提取实验。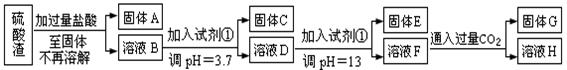
已知溶液pH=3.7时,Fe3+已经沉淀完全;一水合氨电离常数Kb=1.8×10-5,其饱和溶液中c(OH-)约为1×10-3mol·L-1。请回答:
(1)写出A与氢氧化钠溶液反应的化学方程式:。
(2)上述流程中两次使用试剂①,推测试剂①应该是(填以下字母编号)
| A.氢氧化钠 | B.氧化铝 | C.氨水 |
D.水 |
(3)溶液D到固体E过程中需要控制溶液pH=13,如果pH过小,可能导致的后果是;(任写一点)
(4)H中溶质的化学式:;
(5)计算溶液F中c(Mg2+)=( 25℃时,氢氧化镁的Ksp=5.6×10-12)
室温下,水溶液体系中的化学反应I— + OCl— = OI— + Cl—的反应物初始浓度、溶液中的OH—初始浓度及初始速率间的关系如下表所示:
| 实验 编号 |
I—的初始浓度 (mol·L-1) |
OCl—的初始浓度 (mol·L-1) |
OH—的初始浓度 (mol·L-1) |
初始速率v (mol·L-1· s-1) |
| 1 |
2 × 10–3 |
1.5 × 10–3 |
1.00 |
1.8 × 10–4 |
| 2 |
a |
1.5 × 10–3 |
1.00 |
3.6 × 10–4 |
| 3 |
2 × 10–3 |
3 × 10–3 |
2.00 |
1.8 × 10–4 |
| 4 |
4 × 10–3 |
3 × 10–3 |
1.00 |
7.2  × 10–4 × 10–4 |
已 知表中初始反应速率与有关离子浓度关系可以表示为v=" k" [I—]1 [OCl—]b [OH—]c(温度一定时,k为常数)。
知表中初始反应速率与有关离子浓度关系可以表示为v=" k" [I—]1 [OCl—]b [OH—]c(温度一定时,k为常数)。
(1)为开展实验1,某同学取5mL0.02mol·L-1碘化钾溶液、5mL0.015 mol·L-1次氯酸钠溶液、40mL某浓度氢氧化钠溶液混合反应。则该氢氧化钠溶液物质的量浓度为;
(2)实验2中,a="" ;
(3)设计实验2和实验4的目的是;
(4)计算b、c值:b="" ;c = ;
= ;
(5)若实验编号4的其它浓度不变,仅将溶液的酸碱值变更为pH = 13,反应的初始速率v="" 。
部分短周期元素的原子半径及常见化合价如下表:
| 元素代号 |
Z |
M |
Q |
R |
T |
X |
| 原子半径/nm |
0.077 |
0.130 |
0.111 |
0.099 |
0.073 |
0.102 |
| 常见化合价 |
+4 ,-4 |
+2 |
+4 ,-4 |
-1,+7 |
-2 |
+6,-2 |
根据要求回答问题(如需填化学用语的,请用各元素的元素符号表示)
(1) X元素在元素周期表的位置是。
(2) R的气态氢化物比X的气态氢化物 (填稳定或不稳定)。
(填稳定或不稳定)。
(3)写出M的单质与ZT2反应的化学方程式。
(4)Q的最高价氧化物在现代通信的重要用途是。
(5)己知XO2在500℃,1大气压下被氧气氧化,每生成1 mol气态XO3,放出98.3 kJ热量,该反应的热化学方程式是
(6)工业上用Z的单质与水蒸汽反应制水煤气,则该反应的平衡常数表达式K=。
近期市场上出现一种无需火电,无需热水的自热米饭。自热米饭饭盒中有发热包,发热包中有一小包粉末及少量液体(水)。根据要求回答问题:
(1)对发热包中粉末的成分,甲在查阅资料的基础上,认为可能含有镁粉、铁粉、碳粉、氯化钠固体等物质,并通过下述实验来检验:
①将磁铁放置于粉末中,部分固体被吸引,说明粉末中含;
②取①未被磁铁吸引的粉末用水溶解,过滤。往滤液中滴入硝酸银溶液,有白色沉淀,说明粉末含有;
③取步骤②的不溶物,滴加稀硫酸直至过量,过滤,得到黑色固体,说明发热包中含有;
④取步骤③滤液并加入足量氢氧化钠溶液,出现白色沉淀,说明发热包中有。
(2)甲注意到说明书上的提示:使用时,操作控件使发热包中的粉末与液体混合而放热。放热过程分两个阶段:第一阶段,较短的时间内产生大量的热,使饭煮熟;第二阶段,持续温和地放热,达到保温的目的。据此,他认为饭盒工作时应有两个原电池反应发生。
快速发热时负极反应式为,
保温时正极电极反应式。