(13分)A、B、C均为中学化学中的常见物质,它们含有一种相同的元素。请根据题中信息回答问题。
(1)A、B、C三种物质都由短周期元素组成,D是空气的主要成分之一,它们存在如下反应转化关系:
①若A是非金属单质,常温下为固态,A与C在一定条件下能发生反应,则C为_________;A所形成的一种晶体具有高硬度、高熔点特性,它的晶体类型属于__________
②若A是金属单质,则A在元素周期表的位置是_________;已知mgA与足量 反应,生成固体的质量为(m+3.55)g,则等质量的A与D反应完全,生成固体的质量至少为________g
反应,生成固体的质量为(m+3.55)g,则等质量的A与D反应完全,生成固体的质量至少为________g
③若常温时C为红棕色气体,则A可能是__________或 ;工业上用A与D反应制取B的化学方程式为:______________ _。
(2)已知A、B、C、D存在如图所示的反应转化关系: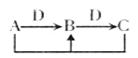
①若D为生活中常见的金属单质,图中反应均为氧化还原反应,请设计一个检验B中阳离子的方案:________________________________。
②若D为强碱,A为常见正盐,A、B、C含有共同元素是生活中常见金属元素,图中反应均为非氧化还原反应,则B是 ;除去B中混有的少量Mg(OH)2的操作步骤是:_ _。(有关答案填写化学式)
海底蕴藏着大量的“可燃冰”。用甲烷制水煤气(CO、H2),再合成甲醇来代替日益供应紧张的燃油。
已知:① CH4(g)+H2O (g)=CO (g)+3H2 (g)△H1=+206.2kJ·mol-1
② CH4(g)+ O2(g)=CO(g)+2H2(g)△H2=-35.4 kJ·mol-1
O2(g)=CO(g)+2H2(g)△H2=-35.4 kJ·mol-1
③ CH4 (g)+2H2O (g)=CO2 (g)+4H2 (g)△H3=+165.0 kJ·mol-1
(1)CH4(g)与CO2 (g)反应生成CO(g)和H2(g)的热化学方程式为。
(2)从原料、能源利用的角度,分析反应②作为合成甲醇更适宜方法的原因是。
(3)水煤气中的H2可用于生产NH3,在进入合成塔前常用[Cu(NH3)2]Ac溶液来吸收其中的CO,防止合成塔中的催化剂中毒,其反应是: [Cu(NH3)2]Ac + CO + NH3  [Cu(NH3)3]Ac·CO△H<0
[Cu(NH3)3]Ac·CO△H<0
[Cu(NH3)2]Ac溶液吸收CO的适宜生产条件应是。
(4)将CH4设计成燃料电池,其利用率更高,装置示意如下图(A、B为多孔性石墨棒)。持续通入甲烷,在标准状况下,消耗甲烷体积VL。0<V≤44.8 L时,电池总反应方程式为。
② 44.8 L<V≤89.6 L时,负极电极反应为。
③ V="67.2" L时,溶液中离子浓度大小关系为。
某课外小组对日常生活中不可缺少的调味品M进行探究。已知C可在D中燃烧发出苍白色火焰。M与其他物质的转化关系如下图所示(部分产物已略去):
(1)写出用惰性电极电解M溶液的离子方程式。
(2)写出F的电子式。
(3)若A是一种常见的酸性氧化物,且可用于制造玻璃,E溶液与F溶液反应可以制备一种胶体,则E溶液的俗称是。
(4)若A是一种常见金属单质,且A与B溶液能够反应,则将过量的F溶液逐滴加入E溶液,边加边振荡,所看到的实验现象是。
(5)若A是一种不稳定的盐,A溶液与B溶液混合将产生白色絮状沉淀且瞬间变为灰绿色,最后变成红褐色的E,向G溶液中加入苯酚溶液后显紫色,则由A转化成E的离子方程式是。
(6)若A是一种化肥。实验室可用A和B反应制取气体E,E与F、E与D相遇均冒白烟,且利用E与D的反应检验输送D的管道是否泄露,写出E与D反应的化学方程式是。若A是一种溶液,只可能含有H+、NH4+、Mg2+、Fe3+、Al3+、CO32-、SO42-中的某些离子,当向该溶液中加入B溶液时发现生成沉淀的物质的量随B溶液的体积发生变化如图所示,由此可知,该溶液中肯定含有的离子及其浓度之比为。
A、B、C、D、E、F、G都是链状有机物,它们的转化关系如图所示。A只含一种官能团,D的相对分子质量与E相差42,D的核磁共振氢谱图上有3个峰,且峰面积之比为1:3:6,请回答下列问题:
已知:Mr(R-Cl)-Mr(ROH)=18.5,Mr(RCH2OH)-Mr(RCHO)=2, Mr表示相对分子质量。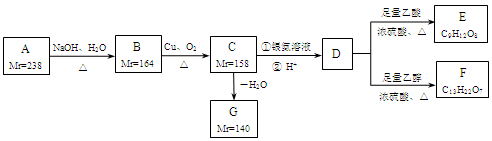
(1)A中含有的官能团是______。
(2)写出D的分子式______。
(3)下列有关A~G的说法正确的是______。
a.每个A分子中含有官能团的数目为4个
b.B中所有官能团均发生反应生成C
c.C生成G只有1种产物
d.G存在顺反异构现象
(4)写出B生成C的化学方程式______。
(5)芳香族化合物H与G互为同分异构体,1mol H与足量氢氧化钠溶液反应消耗2mol NaOH,且H苯环上的一氯代物只有两种,写出其中任意一个符合条件的H的结构简式______。
(6)E与足量NaOH溶液共热,此反应的化学方程式为______。
某研究小组进行Mg(OH)2沉淀溶解和生成的实验探究。
向2支盛有1 mL 1 mol·L-1的MgCl2溶液中各加入10滴2 mol·L-1 NaOH,制得等量Mg(OH)2沉淀;然后分别向其中加入不同试剂,记录实验现象如下表:
| 实验序号 |
加入试剂 |
实验现象 |
| Ⅰ |
4 mL 2 mol·L-1 HCl 溶液 |
沉淀溶解 |
| Ⅱ |
4 mL 2 mol·L-1 NH4Cl 溶液 |
沉淀溶解 |
(1)从沉淀溶解平衡的角度解释实验Ⅰ的反应过程。
(2)测得实验Ⅱ中所用NH4Cl溶液显酸性(pH约为4.5),用离子方程式解释其显酸性的原因。
(3)甲同学认为应补充一个实验:向同样的Mg(OH)2沉淀中加4 mL蒸馏水,观察到沉淀不溶解。该实验的目的是。
(4)同学们猜测实验Ⅱ中沉淀溶解的原因有两种:一是NH4Cl溶液显酸性,溶液中的H+可以结合OH- ,进而使沉淀溶解;二是。
(5)乙同学继续进行实验:向4 mL 2 mol·L-1 NH4Cl溶液中滴加2滴浓氨水,得到pH约为8的混合溶液,向同样的Mg(OH)2沉淀中加入该混合溶液,观察现象。
①实验结果证明(4)中的第二种猜测是成立的,乙同学获得的实验现象是。
③乙同学这样配制混合溶液的理由是。
人类活动产生的CO2长期积累,威胁到生态环境,其减排问题受到全世界关注。
(1)工业上常用高浓度的K2CO3溶液吸收CO2,得溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如下: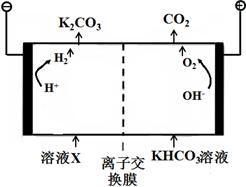
在阳极区发生的反应包括和H ++ HCO3-=H2O+CO2↑。
简述CO32-在阴极区再生的原理。
(2)再生装置中产生的CO2和H2在一定条件下反应生成甲醇等产物,工业上利用该反应合成甲醇。
已知:25 ℃,101 KPa下:
H2(g)+1/2 O2(g)=H2O(g) Δ H1=" -242" kJ/mol
CH3OH(g)+3/2 O2(g)=CO2 (g)+2 H2O(g) Δ H2=" -676" kJ/mol
写出CO2和H2生成气态甲醇等产物的热化学方程式。
下面表示合成甲醇的反应的能量变化示意图,其中正确的是(填字母序号)。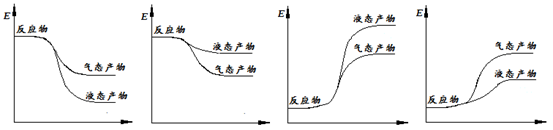
ab c d
(3)微生物燃料电池是一种利用微生物将化学能直接转化成电能的装置。已知某种甲醇
微生物燃料电池中,电解质溶液为酸性,示意图如下: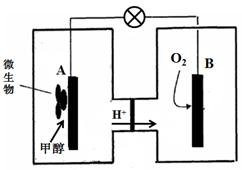
该电池外电路电子的流动方向为(填写“从A到B”或“从B到A”)。
工作结束后,B电极室溶液的pH与工作前相比将(填写“增大”、“减小”或“不变”,溶液体积变化忽略不计)。
A电极附近甲醇发生的电极反应式为。