某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定测定其浓度。
(1)滴定:①用 式滴定管盛装1.00mol/L盐酸标准液。下图表示某次滴定时50 mL滴定管中前后液面的位置。请将用去的标准盐酸的体积填入③表空格中。滴定管中剩余液体的体积 25.10mL(填大于、小于或者等于)。
②下表是3种常见指示剂的变色范围:
| 指示剂 |
石蕊 |
甲基橙 |
酚酞 |
| 变色范围(pH) |
5.0—8.0 |
3.1—4.4 |
8.2—10.0 |
该实验不可选用 作指示剂;若使用酚酞做指示剂滴定终点为__________________
③有关数据记录如下:
| 滴定序号 |
待测液体积(mL) |
所消耗盐酸标准液的体积(mL) |
||
| 滴定前 |
滴定后 |
消耗的体积 |
||
| 1 |
20 |
0.50 |
25.12 |
24.62 |
| 2 |
20 |
如图 |
如图 |
填写_______ |
| 3 |
20 |
6.00 |
30.58 |
24.58 |
(2)根据所给数据,计算出烧碱样品中NaOH的物质的量浓度 mol/L
(3)下列几种情况会使测定结果偏高的是
a.若滴定前用蒸馏水冲洗锥形瓶;
b.滴定后俯视读数;
c.若在滴定过程中不慎将数滴酸液滴在锥形瓶外;
d.若未充分振荡,刚看到溶液变色,立刻停止滴定。
e.未用标准液润洗酸式滴定管
图4-39是用石墨和铁作电极电解饱和食盐水的装置。请填空:
图4-39
(1)X的电极名称是_________极,发生的电极反应式为________,Y极的电极材料是_______。检验X极的产物方法是_____________________。
(2)某同学在实验时误将两种电极材料接反,导致X极上未收到预期产物。一段时间后又将两极的连接方式纠正过来,发现X一端出现了白色沉淀,此沉淀是_______(填化学式)。其形成原因是___________,该沉淀在空气中放置,现象是________________________。
(3)工业上电解饱和食盐水的方法之一,是将两个极室用离子交换膜隔开(如图4-40)其目的是_______,阳极室(A处)加入_______,阴极室(B处)加入_______,离子交换膜只许_________离子通过。
图4-40
图4-38中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极。通电一段时间后,在c、d两极上共收集到336 mL(标准状态)气体。回答: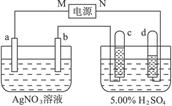
图4-38
(1)直流电源中,M__________为极。
(2)Pt电极上生成的物质是________,其质量为________g。
(3)电源输出的电子,其物质的量与b、c、d各电极分别生成的物质的物质的量之比为:_________∶________∶________∶________。
(4)AgNO3溶液的浓度_______,AgNO3溶液的pH________,H2SO4溶液的浓度______,H2SO4溶液的pH______(填增大、减小或不变)。
(5)若H2SO4溶液的质量分数由5.00%变为5.02%,则原有5.00%的H2SO4溶液为________g。
有如下两个反应(反应所需的其他条件和各物质的化学计量数均已略去):
①X+Y Z+P+Q;②Z+Q
Z+P+Q;②Z+Q X+H+Y。请针对以下两种不同情况来完成:
X+H+Y。请针对以下两种不同情况来完成:
(1)若X是一种日常生活中用作调味剂的盐,反应①是化学工业上制取单质Q和化合物Z的重要方法。则Z的电子式为___________________;反应①中阴极反应为___________________;反应②的离子方程式为______________;在酸性条件下,若将化合物H加到含Fe2+的溶液中,溶液从浅绿色变成黄色,该反应的离子方程式为_______________________________________。
(2)若X是一种含氧酸盐,可用于实验室中检验水的存在。1个X的酸根离子中共含有50个电子,其中含有一种元素R,R的原子最外层电子数是电子层数的2倍,则R在元素周期表中的位置是_________。X单质的熔点是112.8 ℃,则R单质的晶体类型属于______晶体。
(3)若X是(2)中的含氧酸盐,当以石墨作电极电解X溶液时,阳极反应为___________________;原溶液体积为1升,C(H+)=1×10-6mol/L。电解一段时间,当阳极收集到56ml(标况下)气体是,假定溶液体积不变,阴极棒将增重______g,此时电解质溶液的PH为_____。
某校课外实验小组进行铜与浓、稀硝酸反应的实验研究。基本原则是:安全可靠、现象明显,符合环保要求。
如果用图Ⅰ中装置进行铜与浓硝酸反应的实验,最大缺点是产生的NO2气体逸出污染空气;如果用该装置来证明铜与稀硝酸反应生成NO气体,缺点是不易观察到有毒性的NO气体无色的本来面目。
(1)若用装置Ⅱ进行实验,既可克服实验不足,还能使上述反应在同一试管中连续进行。实验如下:组装好装置并检查气密性后,加入2 mL浓硝酸(铜片未接触酸液),塞紧胶塞;向左倾斜试管使其反应发生,当导管口有极少量红棕色气体逸出,溶液呈绿色时,正立试管,使反应停止;同时将导管插入水中,稍后能观察到:a.水沿导管倒吸至试管中,b.________________,c. ________________等明显现象。其中发生的原因用方程式表示为:_________________________________________________________。
(2)当试管中液体体积约占1/2时,从水中取出导管,并伸入一小试管中,管口塞上浸有碱液的棉花(如图Ⅲ)。这样做的目的是:________________,此时大试管中反应的离子方程式为:________________________________________________。
(3)若用右上图Ⅳ所示的装置(U形管、干燥管、A为活塞)制取NO可能更加理想。请补充下列实验步骤:
①检查装置的气密性的方法是:________________________________________________。
②打开活塞A,从U形管右端注入稀硝酸,直到________________________为止。
③关闭活塞A,若反应缓慢,可在U形管左侧加热,观察到____________________。
(6分)有一瓶澄清的溶液,其中可能含有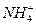 、K+、Na+、Mg2+、Ba2+、Al3+、Fe2+、
、K+、Na+、Mg2+、Ba2+、Al3+、Fe2+、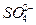 、
、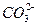 、
、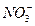 、Cl-、Al O2-、I-,取该溶液进行如下实验:
、Cl-、Al O2-、I-,取该溶液进行如下实验:
(1)用pH试纸实验,表明溶液呈强碱性,焰色反应透过蓝色钴玻璃观察到紫色火焰。
(2)取部分溶液,加入少量CCl4及数滴新制的氯水,经摇荡后,CCl4层呈紫红色。
(3)另取部分溶液,逐滴加入稀HCl溶液,使溶液从碱性逐渐变为酸性,在滴加过程中溶液出现沉淀。滴加完毕后,溶液中沉淀消失。
(4)取部分上述酸性溶液,加BaCl2溶液,有白色沉淀生成。
(5)往(3)得到的酸性溶液通H2S气体,溶液中有浅黄色沉淀产生。
根据上述实验事实确定并完成下列问题:
在溶液中肯定存在哪些离子_________________________________________,
肯定不存在哪些离子_______________________________________________,
还不能确定存在哪些离子___________________________________________。