非金属单质A经如图所示的过程转化为含氧酸D,已知D为强酸,请回答下列问题:
(1)若A在常温下为固体,B是能使品红溶液褪色的有刺激性气味的无色气体。
①D物质的名称是________;请写出由B转化成 C的化学方程式____________________________
②在工业生产中大量排放的B气体被雨水吸收后形成了________而污染了环境。
(2)若A在常温下为气体,C是红棕色的气体。
①A、C的化学式分别是:A________;C________.请写出由C与H2O生成 D的化学方程式
____________________________________________________
②D的浓溶液在常温下可与铜反应并生成C气体,请写出该反应的离子方程式___________________________________________。
垃圾焚烧发电产生的烟气中含烟尘、二氧化硫、氮氧化物、氯化氢等有害物质,处理流程如下: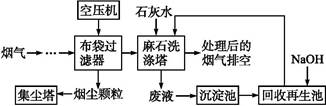
(1)麻石洗涤塔中设置多层格栅,上面放置大量耐酸碱塑料小球
,塔内设置多层上喷下淋水嘴,“烟气”从塔底进入,目的是 。
(2)若NO2和NO气体以物质的量之比1∶1混合通入石灰水中,发生氧化还原反应生成一种正盐和水,请写出反应的化学方程式 ;
已知此正盐的水溶液呈碱性,用离子方程式表示 。
(3)废液在沉淀池中慢慢沉降,沉淀主要含 ;在回收再生池中加入NaOH固体的作用是
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂,其生产工艺如下:
已知:①2KOH+Cl2 KCl+KClO+H2O(条件:温度较低)
KCl+KClO+H2O(条件:温度较低)
②6KOH+3Cl2 5KCl+KClO3+3H2O(条件:温度较高)
5KCl+KClO3+3H2O(条件:温度较高)
③2Fe(NO3)3+3KClO+10KOH 2K2FeO4+6KNO3+3KCl+5H2O
2K2FeO4+6KNO3+3KCl+5H2O
回答下列问题:
(1)该生产工艺应在 (填“温度较高”或“温度较低”)的情况下进行。
(2)写出工业上制取Cl2的化学方程式 。
(3)K2FeO4可作为新型多功能水处理剂的原因 。
(4)配制KOH溶液时,是在每100 mL水中溶解61.6 g KOH固体(该溶液的密度为1.47 g·mL-1),它的物质的量浓度为
(5)在“反应液Ⅰ”中加入KOH固体的目的是:① ;② 。
;② 。
(6)从“反应液Ⅱ”中分离出K2FeO4后,副产品是 (写化学式)。
空气吹出法工艺,是目前“海水提溴”的最主要方法之一。其工艺流程如下: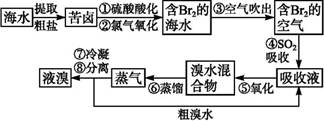
(1)溴在周期表中位于 周期 族。
(2)步骤①中用硫酸酸化可提高Cl2的利用率,理由是
(3)步骤④利用了SO2的还原性,反应的离子方程式为
(4)步骤⑥的蒸馏过程中,温度应控制在80~90 ℃,温度过高或过低都不利于生产,请解释原因 。
(5)步骤⑧中溴蒸气冷凝后得到液溴与溴水的混合物,可利用它们的密度相差很大的特点进行分离。分离仪器的名称是 。
(6)步骤①、②之后并未直接用“含Br2的海水”进行蒸馏得到液溴,而是经过“空气吹出”“SO2吸收”“氧化”后再蒸馏,这样操作的意义是 。
(1)某工厂每天要烧掉含硫1.6%的烟煤200 t,排放出的SO2会严重污染环境,如果变废为宝,将这些SO2回收利用,那么理论上每年(按365 d计)可生产98%的浓硫酸 吨;
(2)若要在铁制件表面镀镍,则镍应与电源的 极相连,电镀液可以用硫酸镍溶液,电镀过程中硫酸镍溶液的浓度会 (填“增大”“减小”或“不变”);
(3)工业上制造水泥、玻璃时都要用到的原料是 (填编号),用所选原料制玻璃的化学方程式是 ;
| A.纯碱 | B.熟石灰 | C.石灰石 | D.黏土 |
(4)炼铁和炼钢过程的主要区别是 ;
(5)明矾净化水的原理是
(用离子方程式表示);具有暂时硬度的水中除去Mg2+的方法是 、
(用化学方程式表示)。
工业上用化学气相沉积法制备氮化硅,其反应如下:3SiCl4(g)+2N2(g)+6H2(g)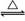 Si3N4(s)+12HCl(g) ΔH<0
Si3N4(s)+12HCl(g) ΔH<0
某温度和压强条件下,分别将0.3 mol SiCl4(g)、0.2 mol N2(g)、0.6 mol H2(g)充入2 L密闭容器内,进行上述反应,5 min达到平衡状态,所得Si3N4(s)的质量是5.60 g。
(1)H2的平均反应速率是 mol·L-1·min-1。
(2)平衡时容器内N2的浓度是 mol·L-1。
(3)SiCl4(g)的转化率是 。
(4)若按n(SiCl4)∶n(N2)∶n(H2)=3∶2∶6的投料配比,向上述容器不断扩大加料,SiCl4(g)的转化率应 (填“增大”“减小”或“不变”)。
(5)在不改变反应条件的情况下,为了提高SiCl4(g)的转化率,可通过改变投料配比的方式来实现。下列四种投料方式,其中可行的是 。
| 选项 |
投料方式 |
| A |
n(SiCl4)∶n(N2)∶n(H2)=1∶1∶2 |
| B |
n(SiCl4)∶n(N2)∶n(H2)=" " 1∶2∶2 |
| C |
n(SiCl4)∶n(N2)∶n(H2)=" " 3∶2∶2 |
| D |
n(SiCl4)∶n(N2)∶n(H2)=" " 2∶1∶3 |
(6)达到平衡后升高温度,其他条件不变,对平衡体系产生的影响是 (填字母序号)。
A.c(HCl)减少
B.正反应速率减慢,逆反应速率加快
C.Si3N4的物质的量减小
D.重新平衡时c(H2)/c(HCl)增大