镁是海水中含量较多的金属,镁合金及其镁的化合物用途非常广泛。
(1)Mg2Ni是一种储氢合金,已知:
Mg(s)+H2(g)=MgH2(S) △H1="-" 74.5kJ·mol-1
Mg2Ni(s)+2H2(g)=Mg2NiH4(s) △H2="-" 64.4kJ·mol-l
则:Mg2Ni(s)+2MgH2(s)=2Mg(s)+Mg2NiH4(s)的△H3= .
(2)某科研小组用水氯镁石(主要成分为MgCl2·6H2O)制备金属镁工艺的关键流程如下:
科研小组将MgCl2·6H2O在氩气气氛中进行热重分析,结果如下图(TG表示残留固体质量占原样品总质量的百分数)。

①图中AB线段为“一段脱水”,试确定B点对应固体物质的化学式____ ;图中BC线段为“二段脱水”,在实验中通入H2和Cl2燃烧产物的目的是 。
②该工艺中,可以循环使用的物质有___ 。
(3)CH3MgCl是一种重要的有机合成剂,其中镁的化合价是 ,该化合物水解时生成甲烷、氯化镁和氢氧化镁,请写出该反应的化学方程式 。
(4)储氢材料Mg(AIH4)2在110~200℃的反应为:Mg(AIH4)2=MgH2+2Al+3H2↑;每转移3 mol电子生成Al的质量为____ 。
(5)“镁一次氯酸盐”燃料电池的装置如右图所示,该电池的正极反应式为 。
个化学反应,我们不但关心物质变化和能量变化,还通常要研究化学反应的快慢
(1)用纯净的锌粒和盐酸反应制取氢气,回答:
实验过程如下图所示,分析判断:________段化学反应速率最快,原因是,_______段收集的氢气最多。
为了加快上述反应的速率,欲向溶液中加入一定量下列物质,你认为可行的是
A.胆矾晶体 B.硫酸氢钠固体
C.氯化锌浓溶液 D.浓硝酸
除了上述方法外,你认为还可以采取措施来加快化学反应速率。
(2)下图表示800℃时,A、B、C三种气体物质的浓度随时间变化的情况,t是达到平衡状态的时间。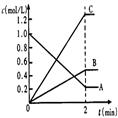
试回答
①该反应的化学方程式为_________________________________。
②达到平衡状态的所需时间是2min,A物质的平均化学反应速率为____________
氢能源是21世纪极具发展前景的新能源之一,它既是绿色能源,又可循环使用。
(1)请在下图的两个空格中填上循环过程中反应物和生成物的分子式,以完成理想的氢能源循环体系图(循环中接受太阳能的物质在自然界中广泛存在)。
(2)从能量转换的角度看,过程Ⅱ应是_________能转化为_________能。
(3)该燃料电池中以KOH溶液作电解质溶液,请写出该电池的电极反应式:
负极____________________________________;
正极____________________________________。
该燃料电池的优点为
列几组物质中,互为同位素的有__________,互为同素异形体(同一种元素形成的不同的单质)的有________,互为同系物的有____________,互为同分异构体的有____________________,属于同种物质的有__________。
①O2和O3 ②35Cl和37Cl ③CH3CH3和CH3CH2CH3④CH3CH2CH(CH3)CH2CH3和
CH3CH2CH(CH3)CH(CH3)CH3
⑤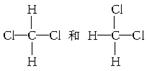
⑥CH3(CH2)2CH3和(CH3)2CHCH3⑦CH3CH(CH3)CH3和CH(CH3)3
X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大。X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子。
请回答下列问题:
(1)Y在元素周期表中的位置为______。
(2)上述元素的最高价氧化物对应的水化物酸性最强的是______(写化学式),
(3)Y、G的单质或两元素之间形成的化合物可作水消毒剂的有______(写出其中两种物质的化学式)。
(4)ZX的电子式为______;ZX与水反应放出气体的化学方程式为________________________________________________________________________。
前四周期元素W、X、Y、Z的原子序数依次增大,W的原子最外层电子数是次外层电子数的3倍。X、Y和Z分属不同的周期,他们的原子序数之和是W原子序数的5倍。W可以与Y组成YW型化合物。请回答下列问题:
(1)W元素原子的L层电子排布式为,W3分子中的化学键类型;
(2)X单质与水发生主要反应的化学方程式为;
(3)X的氢化物沸点与同主族下一周期的元素的氢化物的沸点比较,沸点较高的是 ( 用化学式表示)原因是
(4)含有元素Z的盐的焰色反应为色。许多金属的盐都可以发生焰色反应,其原因是。