[化学——选修2:化学与技术]磷矿石主要以磷酸钙[Ca3(PO4)2 H2O]和磷灰石[Ca5F(PO4)3、Ca5(OH)(PO4)3]等形式存在。图(a)为目前国际上磷矿石利用的大致情况,其中湿法磷酸是指磷矿石用过量硫酸分解制备磷酸。图(b)是热法磷酸生成过程中由磷灰石制单质磷的流程。
H2O]和磷灰石[Ca5F(PO4)3、Ca5(OH)(PO4)3]等形式存在。图(a)为目前国际上磷矿石利用的大致情况,其中湿法磷酸是指磷矿石用过量硫酸分解制备磷酸。图(b)是热法磷酸生成过程中由磷灰石制单质磷的流程。
图(a)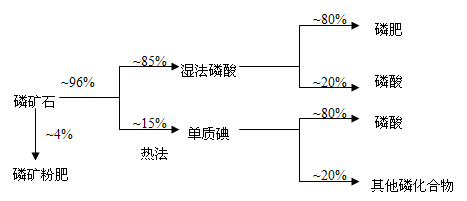
图(b)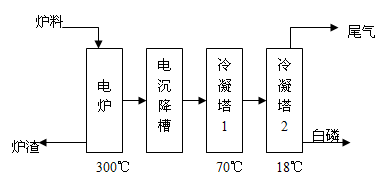
部分物质的相关性质如下:
| |
熔点/℃ |
沸点/℃ |
备注 |
| 白磷 |
44 |
280.5 |
|
| PH3 |
-133.8 |
-87.8 |
难溶于水,具有还原性 |
| SiF4 |
-90 |
-86 |
易水解 |
回答下列问题:
(1)世界上磷矿石最主要的用途是生产含磷肥料,约占磷矿石使用量的 ℅。
(2)以磷灰石为原料,湿法磷酸过程中Ca3F(PO4)3反应的化学方程式为: 。现有1吨折合含有五氧化二磷约30%的磷灰石,最多可制得85℅的商品磷酸 吨。
(3)如图(b)所示,热法生产磷酸的第一步是将二氧化硅、过量焦炭与磷灰石混合,高温反应生成白磷。炉渣的主要成分是: (填化学式)冷凝塔1的主要沉积物是: 冷凝塔2的主要沉积物是:
(4)尾气中主要含有 ,还含有少量PH3、H2S和HF等,将尾气先通入纯碱溶液,可除去 ;再通入次氯酸钠溶液,可除去 (均填化学式)
(5)相比于湿法磷酸,热法磷酸工艺复杂,能耗高,但优点是: 。
某课外小组同学用下图所示装置进行实验(夹持装置已省略)。
(1)用该装置制备NO2并研究其性质。
①收集一试管NO2,取下试管B倒立在水中,观察到的现象是________________。
②该反应的化学方程式是________________________________。
③C中NaOH溶液吸收NO2,生成两种盐,且被氧 化与被还原的NO2的物质的量之比是1:1,请写出该反应的离子方程式________________________________。
(2)该装置也可用于制备Cl2并研究其性质。
①若A中固体为漂白粉,滴入浓盐酸,则A中发生反应的化学方程式是___________。
②在B中放一小块湿润的淀粉碘化钾试纸,可观察到试纸变蓝,请结合离子方程式解释原因________________________________________。
③硫代硫酸钠(Na2S2O3)可替代NaOH溶液吸收氯气,已知25.0mL 0.1 mol·L-1的Na2S2O3溶液恰好把标准状况下224 mL Cl2完全转化为Cl-时,S2O32-转化成_____(填选项)。
a. S2- b. S c. SO32- d. SO42-
有一无色透明溶液,欲确定是否含有下列离子:Na+、Mg2+、Ba2+、NO3-、SO42-、Cl-、CO32-,实验如下:
| 实验步骤 |
实验现象 |
| ①取少量原溶液,加入几滴酚酞试液 |
溶液变成红色 |
| ②取少量原溶液加热浓缩,加入Cu片和一定浓度的H2SO4 |
有无色气体产生,该气体遇空气变成红棕色 |
| ③取少量原溶液,加入BaCl2溶液 |
有白色沉淀生成 |
| ④取③中上层清液,先加入稀硝酸,再加入AgNO3溶液 |
有白色沉淀生成 |
由此判断:
(1)溶液中肯定存在的离子是________________________,肯定不存在的离子是________________,可能存在的离子是________________。
(2)实验②中生成无色气体的离子方程式是________________________________。
(3)为进一步确定可能存在的阴离子,应该补充的实验设计是__________________。
经精选后的铝土矿A(主要成份为Al2O3,含有一定量的Fe2O3、SiO2杂质),可用A来制备电解铝原料——氧化铝,某课外小组同学模拟该过程,设计了如下方案:
请回答:
(1)A中Al2O3与过量氢氧化钠溶液反应的化学方程式是________________
(2)操作I的名称是________________。
(3)下列说法中正确的是________(填选项)。
a 操作Ⅱ是灼烧 b. 滤液3所含阳离子是Fe3+、Al3+
c. 试剂b可用氢氧化钠 d. 为保证转化完全,所加试剂a和试剂b均应过量
(4)写出滤液2、4混合后生成Al(OH)3的离子方程式是______________________ __
钠、铝和铁是三种重要的金属。请回答:
(1)钠原子的结构示意图是________________。
(2)三种金属中,既能与盐酸又能与氢氧化钠溶液反应的是_________(填化学式),写出其与氢氧化钠溶液反应的离子方程式________。
(3)三种金属在一定条件下均能与水发生反应。其中,铁与水蒸气反应的化学方程式是_____________________。取一小块金属钠放在滴有酚酞的水中,实验现象正确的是________(填选项)。
①钠浮在水面迅速反应②钠沉在水底迅速反应③钠熔成小球并快速游动
④反应中可以听到嘶嘶的响声⑤反应后的溶液变为红色
a. ①④⑤ b. ②③④⑤ c. ①③④⑤
(4)铁、铝是常用的金属材料,在空气中铝比铁更耐腐蚀。对此合理的解释是______ __________________________。
在放电条件下,氮气与氧气可直接化合:N2+O2 2NO。该反应中,氧化剂是________(填化学式),若反应中消耗了1 mol N2,则转移_______mol电子。
2NO。该反应中,氧化剂是________(填化学式),若反应中消耗了1 mol N2,则转移_______mol电子。