香豆素是一种天然香料,存在于黑香豆、兰花等植物中。工业上常用水杨醛与乙酸酐在催化剂存在下加热反应制得:
以下是由甲苯为原料生产香豆素的一种合成路线(部分反应条件及副产物已略去)
已知以下信息:
①A中有五种不同化学环境的氢;
②B可与FeCl3溶液发生显色反应;
③同一个碳原子上连有两个羟基通常不稳定,易脱水形成羰基。
请回答下列问题:
(1)A的化学名称为__________;
(2)香豆素的分子式为_______;由甲苯生成A的反应类型为___________;
(3)B的同分异构体中含有苯环的还有_____种,其中在核磁共振氢谱中只出现四组峰的有_____种;
(4)由B生成C的化学反应方程式为___________;
(5)D的同分异构体中含有苯环的还有______种,其中:既能发生银境反应,又能发生水解反应的是________(写结构简式)。
X、Y、Z、W四种化合物均由短周期元素组成,其中X含有四种元素,X、Y、Z的焰色反应均为黄色,W为无色无味气体。这四种化合物具有如下转化关系:(部分反应物、产物及反应条件已略去)。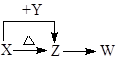
请回答下列问题:
(1)X与Y在水溶液中反应的离子方程式为;
(2)W的结构式为
(3)将Z装入圆底烧瓶,利用下图装置(夹持固定装置已略去)进行实验,装置Ⅱ中的物质由短周期元素组成,装置Ⅲ中产生白色沉淀,装置Ⅴ 中可收集到一种能使带火星木条复燃的气体。装置Ⅱ中物质的化学键类型为 ;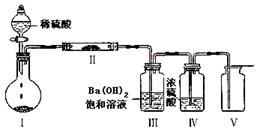
(4)下列关于X、Z的鉴别方法不正确的是
| A.分别加热X、Z的粉末,将产生的气体通入澄清石灰水,观察现象 |
| B.分别将X、Z配成稀溶液,逐滴滴加稀盐酸,观察现象 |
| C.分别将X、Z配成稀溶液,分别加入氯化钙溶液,观察现象 |
| D.分别将X、Z配成稀溶液,分别加入澄清石灰水,观察现象 |
下表给出了五种元素的相关信息,其中A、B、C、D为短周期元素。
| 元素 |
相 关 信 息 |
| A |
在常温、常压下,其单质是气体,随着人类对环境的认识和要求的提高,它将成为倍受青睐的清洁燃料。 |
| B |
工业上通过分离液态空气获得其单质,其某种同素异形体是保护地球地表环境的重要屏障。 |
| C |
植物生长三要素之一,它能形成多种氧化物,其中一种是早期医疗中使用的麻醉剂。 |
| D |
室温下其单质呈粉末状固体,加热易熔化。该单质在氧气中燃烧,发出明亮的蓝紫色火焰。 |
| E |
它是人体不可缺少的微量元素,其单质也是工业生产中不可缺少的金属原材料,常用于制造桥梁、轨道等。 |
根据上述信息填空:
(1)E 在元素周期表中的位置是
(2)D的单质与烧碱水溶液加热时自身的氧化还原反应生成两种具有强还原性的阴离子,写出该反应的离子方程式。
(3)C与A形成的化合物X,分子中原子个数比为1∶2;相同条件时,相同质量时,氢气的体积为X气体体积的16倍;分子中有极性键和非极性键,可作火箭燃料。写出X分子的电子式
(4)以上这五种元素能组成一种工业上用途极广的复盐(类似明矾,含一种阴离子和两种阳离子),该物质中的A、B、C、D、E的质量比为5∶56∶7∶16∶14。请写出该化合物的化学式(要求:用离子及分子最简单个数比的形式表达)
现有如下两个反应:
A.2NaOH+H2SO4 = Na2SO4+2H2O B.CH4+2O2 = CO2+2H2O
(1)根据反应的本质,两个反应都为反应(放热或吸热),判断两个反应能否设计为原电池?(填“能或不能”)AB
(2)如果能,最好应选择作电解质溶液(NaOH或H2SO4)。则负极电极反应式:,正极电极反应式:(若均不能则此问不填)
Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液。
(1)该电池的负极材料是 。负极的电极反应为
(2)若ZnCl2-NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是 。欲除去Cu2+,最好选用下列试剂中的 (填代号)。
a.NaOH b.Zn c.Fe d.NH3·H2O
有一包固体物质,可能含有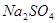 、
、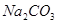 、
、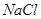 、
、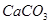 、
、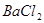 、
、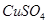 中的一种或几种,现做如下实验。请填空回答其中的问题:
中的一种或几种,现做如下实验。请填空回答其中的问题:
(1)将此固体充分溶解于水中,得到白色沉淀,上层为无色溶液;过滤后,在白色沉淀中滴加足量稀硝酸,未见沉淀溶解。由此可知,原固体物质中一定含有,可能含有。
(2)为确定原固体物质中“可能含有”的物质是否存在,现取3.5g原固体,充分溶于水中,将得到的白色沉淀洗涤、烘干后称量,质量为2.33g。通过计算确定:“可能含有”的物质(选填“一定存在”、“一定不存在”或“仍不能确定是否存在”)。