(1)按要求写出化学式:
①石灰石的主要成分 ;②纯碱 ;③漂白液的有效成分 ;
(2)将下列6个反应分成两类:
①白色的Fe(OH)2先变成灰绿最后变成红褐色;
②NaOH腐蚀玻璃;
③铝屑溶于NaOH溶液;
④小苏打受热分解;
⑤NO2被水吸收;
⑥NH4Cl与熟石灰反应;
第一类是 ;第二类是 (填序号)。分类依据是 。
工业常用燃料与水蒸气反应制备H2和CO, 再用H2和CO合成甲醇。
(1)制取H2和CO通常采用:C(s)+H2O(g)  CO(g)+H2(g) △H=+131.4 kJ·mol-1,下列判断正确的是。
CO(g)+H2(g) △H=+131.4 kJ·mol-1,下列判断正确的是。
a.该反应的反应物总能量小于生成物总能量
b.标准状况下,上述反应生成1L H2气体时吸收131.4 kJ的热量
c.若CO(g)+H2(g) C(s)+H2O(1) △H=-QkJ·mol-1,则Q<131.4
C(s)+H2O(1) △H=-QkJ·mol-1,则Q<131.4
d.若C(s)+CO2(g) 2CO(g) △H1;CO(g)+H2O(g)
2CO(g) △H1;CO(g)+H2O(g) H2(g)+CO2(g) △H2则:△H1+△H2=+131.4 kJ·mol-1
H2(g)+CO2(g) △H2则:△H1+△H2=+131.4 kJ·mol-1
(2)甲烷与水蒸气反应也可以生成H2和CO,该反应为:CH4(g)+H2O(g) CO(g)+3H2(g)
CO(g)+3H2(g)
已知在某温度下2L的密闭绝热容器中充入2.00mol甲烷和1.00mol水蒸气,测得的数据如下表:
| 不同时间各物质的物质的量/mol |
||||
| 0 min |
2min |
4min |
6min |
|
| CH4 |
2.00 |
1.76 |
1.60 |
n2 |
| H2 |
0.00 |
0.72 |
n1 |
1.20 |
根据表中数据计算:
①0 min~2min内H2的平均反应速率为。
②达平衡时,CH4的转化率为。在上述平衡体系中再充入2.00mol甲烷和1.00mol水蒸气,达到新平衡时H2的体积分数与原平衡相比(填“变大”、“变小”或“不变”),可判断该反应达到新平衡状态的标志有______。(填字母)
a.CO的含量保持不变
b.容器中c(CH4)与c(CO)相等
c.容器中混合气体的密度保持不变
d.3ν正(CH4)=ν逆(H2)
(3)合成甲醇工厂的酸性废水中含有甲醇(CH3OH),常用向废液中加入硫酸钴,再用微生物电池电解,电解时Co2+被氧化成Co3+,Co3+把水中的甲醇氧化成CO2,达到除去甲醇的目的。工作原理如下图(c为隔膜,甲醇不能通过,其它离子和水可以自由通过)。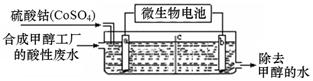
①a电极的名称为。
②写出除去甲醇的离子方程式。
③微生物电池是绿色酸性燃料电池,写出该电池正极的电极反应式为。
【化学——选修3:物质结构与性质】X、Y、Z、L四种元素分别位于周期表中三个紧相邻的周期且原子序数依次增大,它们相关信息如下:
X元素原子的价电子构型为nsnnp2n
Y和Z位于同一周期,最外层都有两个未成对电子
L元素原子的基态未成对电子数是同周期最多的元素。
请回答如下问题:
(1)L元素在周期表中的位置是。
该原子核外电子排布式是。
其最高正价氧化物对应的水化物的化学式是和。
(2)元素X与Y形成的化合物晶体类型是晶体
1mol该化合物含有的化学键数为(用阿伏加德罗常数NA表示)
(3)元素M是周期表中电负性最强的元素,X与M形成的化合物XM2的分子几何构型是,该化合物中X原子的杂化轨道类型是。
(4)X与碳、氢三种元素形成的相对分子质量最小的分子里有个δ键,个л键
(5)金属元素N与Z形成的离子化合物的晶胞结构如图,晶胞中Z离子数目为。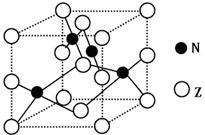
【化学——选修2:化学与技术】海洋是一个丰富的资源宝库,通过海水的综合利用可获得许多物质供人类使用。
(1)海水中盐的开发利用:
①海水制盐目前以盐田法为主,建盐田必须选在远离江河入海口,多风少雨,潮汐落差大且又平坦空旷的海滩。所建盐田分为贮水池、池和结晶池。
②工业上通常以NaCl、CO2和NH3为原料制取纯碱,请写出第一步制取NaHCO3的化学方程式:。
(2)电渗析法是近年来发展起来的一种较好的海水淡化技术,其原理如图所示。其中具有选择性的阴离子交换膜和阳离子交换膜相间排列。请回答下面的问题: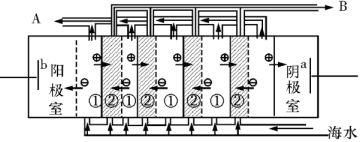
ⅰ电渗析法淡化海水中阴极室可获得的重要化工原料有。
ⅱ上图中虚线部分表示离子交换膜。淡水从(A或B)排出。
(3)用苦卤(含Na+、K+、Mg2+、Cl-、Br-等离子)可提取溴,其生产流程如下: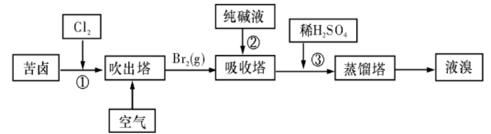
ⅰ.写出反应③的离子方程式为:。
ⅱ.通过①氯化已获得含Br2的溶液,为何还需经过吹出、吸收、酸化来重新获得含Br2的溶液?。
ⅲ.向蒸馏塔中通入水蒸气加热,控制温度在90℃左右进行蒸馏的原因是。。
I.研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,同温度下涉及如下反应:
a、2NO(g)+Cl2(g)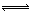 2ClNO(g) ∆H1<0其平衡常数为K1
2ClNO(g) ∆H1<0其平衡常数为K1
b、2NO2(g)+NaCl(s)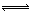 NaNO3(s)+ClNO(g)∆H2<0其平衡常数为K2
NaNO3(s)+ClNO(g)∆H2<0其平衡常数为K2
(1)4NO2(g)+2NaCl(s)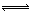 2NaNO3(s)+2NO(g)+Cl2(g) ∆H3的平衡常数K=(用K1、K2表示)。∆H3=(用∆H1、∆H2表示)。
2NaNO3(s)+2NO(g)+Cl2(g) ∆H3的平衡常数K=(用K1、K2表示)。∆H3=(用∆H1、∆H2表示)。
(2)为研究不同条件对反应a的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,10min时反应a达到平衡。测得10min内υ(ClNO)=7.5×10-3mol•L-1•min-1,则平衡后n(Cl2)=mol,NO的转化率α1=。其它条件保持不变,反应(1)在恒压条件下进行,平衡时NO的转化率为α2,α1α2(填“>”“<”或“=”),平衡常数K1(填“增大”“减小”或“不变”)。若要使K1减小,可采用的措施是。
II.第三代混合动力车目前一般使用镍氢电池,该电池中镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH)为电解质溶液.镍氢电池充放电原理示意如图: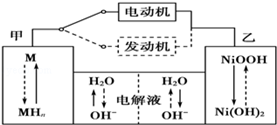
其总反应式为H2+2NiOOH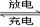 2Ni(OH)2 。根据所给信息判断,混合动力车上坡或加速时,甲电极周围溶液的pH(填“增大”“减小”或“不变”), 乙电极的电极反应式。
2Ni(OH)2 。根据所给信息判断,混合动力车上坡或加速时,甲电极周围溶液的pH(填“增大”“减小”或“不变”), 乙电极的电极反应式。
【化学—选修3:物质结构与性质】X、Y、Z、W四种元素分别位于周期表中三个紧邻的周期,且原子序数逐渐增大,X和Y的氢化物都比同族下一周期元素氢化物的沸点高,但在同周期中却不是最高的。Z是同周期元素中离子半径最小的元素。W原子的价电子层上有两个运动状态不同的电子。请回答下列问题: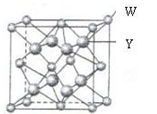
(1)X、Y两种元素的元素符号是:、。X、Y可以形成一种共价化合物,其中两种元素最外层电子数都达到8,则其分子的空间构型是:;中心原子的杂化方式是:。这种化合物不易作配体形成配离子的原因是。
(2)X的氢化物易溶于水的原因是:。
(3)Z的电子排布式是:。根据元素原子的外围电子排布特征,可将周期表分成五个区域,其中Z属于区。
(4)W与Y形成的化合物的晶胞边长为a pm。晶胞中含有________个W离子、W离子的配位数是,晶体的密度是________g·cm-3。(只要求列算式,不必计算出数值,阿伏加德罗常数数值为NA)。