(A)【化学—物质结构与性质】
物质中铁含量的测定方法是多种多样的。
I.土壤中铁含量的测定是先将Fe3+还原为Fe2+,然后使Fe3+与邻啡罗啉 结合显橙红色,再用比色法测定。其中涉及以下反应:4FeCl3 + 2NH2OH·HCl=4FeCl2 + N2O↑+ 6HCI + H2O。
结合显橙红色,再用比色法测定。其中涉及以下反应:4FeCl3 + 2NH2OH·HCl=4FeCl2 + N2O↑+ 6HCI + H2O。
(1)基态Fe2+的核外电子排布式为 。
(2)羟胺(NH2OH)中采用sp3杂化的原子是 ;羟胺极易溶于水,主要原因是 。
(3)羟胺的组成各元素中,元素的第一电离能(I1)由大到小的顺序为 (用元素符号表示)。
(4)吡啶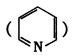 和邻啡罗啉都是含氮的有机物,l mol吡啶中含有σ键的物质的量为 mol。
和邻啡罗啉都是含氮的有机物,l mol吡啶中含有σ键的物质的量为 mol。
Ⅱ.奶粉中铁含量的测定是在酸性介质中使Fe3+与K4Fe(CN)6生成普鲁士蓝(Ⅱ)(化学式为Fe4[Fe(CN)6]3),再用光度法测定铁的含量。反应原理如下:
3K4Fe(CN)6+4FeCl3=Fe4[Fe(CN)6]3↓+12KCl
(5)Fe4[Fe(CN)6]3是一种配合物,其中含有的化学键有_______;
a.共价键
b.氢键
c.配位键
d.金属键
e.离子键
(6)若K4 Fe(CN)6和FeCl3的物质的量按某种比例发生反应,可生成普鲁士蓝(I),其晶胞结构如下图所示:据此判断普鲁士蓝(I)中n(K+):n(Fe3+):n (Fe2+):n (CN—)= 。
(1)已知:Fe(s)+1/2O2(g)═2FeO(s)△H1=-272.0kJ•mol-1①;
2Al(s)+3/2O2(g)═Al2O3(s)△H2=-1675.7kJ•mol-1②
Al和FeO发生铝热反应的热化学方程式是。
(2)某可逆反应在不同条件下的反应历程分别为A、B,如图所示。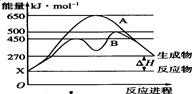
①据图判断该反应达到平衡后,其他条件不变,升高温度,反应物的转化率(填“增大”“减小”或“不变”)。
②其中B历程表明此反应采用的条件为(选填序号)。
A.升高温度
B.增大反应物的浓度
C.降低温度
D.使用催化剂
(3)1000℃时,硫酸钠与氢气发生下列反应:Na2SO4(s)+4H2(g) Na2S(s)+4H2O(g)。该反应的平衡常数表达式为;已知K1000℃< K1200℃,若降低体系温度,混合气体的平均相对分子质量将会(填“增大”“减小”或“不变”)。
Na2S(s)+4H2O(g)。该反应的平衡常数表达式为;已知K1000℃< K1200℃,若降低体系温度,混合气体的平均相对分子质量将会(填“增大”“减小”或“不变”)。
(4)常温下,如果取0.1 mol/LHA溶液与0.1 mol/lNaOH溶液等体积混合(混合后溶液体积的变化忽略不计),测得混合液的pH=8。
①混合液中由水电离出的OH一浓度与0.1 mol/lNaOH溶液中由水电离出的OH一浓度之比为。
②已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,
试推断(NH4)2 CO3溶液的pH (填“<”“>”或“=”)7;
相同温度下,等物质的量浓度的下列四种盐溶液按pH由大到小的排列顺序为(填序号)。
a.NH4HCO3b.NH4Ac.(NH4)2CO3d.NH4Cl
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题。
(1)常温下,某Na2CO3溶液的pH=12,则水电离的c(H+)=。若向该Na2CO3溶液中加入等体积、等物质的量浓度的盐酸,溶液中离子浓度大小排序为。此时溶液中水的电离程度(填“大于”等于或小于”) Na2CO3溶液中水的电离程度。
(2)合成氨反应N2(g)+3H2 (g) 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,
则平衡(填“向正反应方向”“向逆反应方向”或“不”)移动。
(3)一定温度下,在密闭容器中可发生下列反应:2N2O5(g) 4NO2(g)+O2 (g)。下表为反应在T1温度下的部分实验数据:则500 s内N2O5的分解速率V(N2O5)=;降温至T2,反应进行1 000 s时测得c(NO2)=4.98 mol/L。则反应2N2O5(g)
4NO2(g)+O2 (g)。下表为反应在T1温度下的部分实验数据:则500 s内N2O5的分解速率V(N2O5)=;降温至T2,反应进行1 000 s时测得c(NO2)=4.98 mol/L。则反应2N2O5(g) 4NO2(g)+O2 (g)的△H(填“>=或<”)0。
4NO2(g)+O2 (g)的△H(填“>=或<”)0。
| T/s |
0 |
500 |
1000 |
| c(N2O5)/mol•L-1 |
5.00 |
3.50 |
2.42 |
(4)最近美国Simons等科学家发明了使NH3直接用于燃料电池的方法,其装置用铂黑作电极、加入电解质溶液中,一个电极通入空气,另一电极通入NH3。其电池反应式为:4NH3+3O2=2N2+6H2O。你认为电解质溶液应显(填“酸性”“中性”或“碱性”),写出正极的电极反应方程式:。
铁、铜单质及其化合物应用范围很广。现有含氯化亚铁杂质的氯化铜晶体(CuCl2·2H2O),为制取纯净的CuCl2·2H2O,首先将其制成水溶液,然后按如图步骤进行提纯: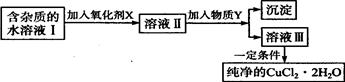
已知Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH,见下表:
| Fe3+ |
Fe2+ |
Cu2+ |
|
| 氢氧化物开始沉淀时的pH |
1.9 |
7.0 |
4.7 |
| 氢氧化物完全沉淀时的pH |
3.2 |
9.0 |
6.7 |
请回答下列问题。
(1)加入氧化剂的目的是。
(2)最适合作氧化剂X的是。
A.K2Cr2O7B.NaClO C.H2O2D.KMnO4
(3)加入的物质Y是。
(4)若不用物质Y而是直接用碱能不能达到目的?(填“能”或“不能”)。若能,不用回答;若不能,试解释原因:。
(5)最后能不能直接蒸发结晶得到CuCl2·2H2O晶体?(填“能”或“不能”)。若能,不用回答;若不能,回答该如何操作? 。
(6)若向溶液Ⅱ中加入碳酸钙,产生的现象是。
(7)若向溶液Ⅱ中加入镁粉,产生的气体是。试解释原因:。
(8)FeCl3溶液具有净水作用的原因是。
有机物D是一种合成抗高血压药的重要通用中间体,其合成路线如下:(已知A是一种芳香酸)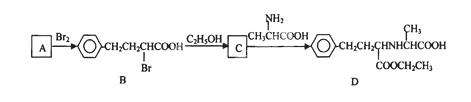
(1)A、C的结构简式分别是、。D中含有的含氧官能团名称是。
(2)C→D的反应类型是。
(3)加热条件下,C在足量NaOH水溶液中反应的化学方程式是。
(4)E是一种相对分子质量比A小14的芳香酸。写出满足下列条件的E的所有同分异构体的结构简式:。
①能发生银镜反应 ②一定条件下可发生水解反应 ③分子的核磁共振氢谱中有四组峰。
(5)F是B在碱溶液中水解后再酸化的产物。F在一定条件下可聚合成高分子化合物,写出该反应的化学方程式。
发展低碳经济,构建低碳社会。科学家们提出利用以工业废气中的CO2为原料,以CuO与ZnO混合物为催化剂,其反应为:CO2+3H2 CH3OH + H2O。
CH3OH + H2O。
(1)某温度下,在体积为l L的密闭容器中充入lmol CO2和4molH2,测得CO2和CH3OH(g)的浓度随时间变化如Ⅰ图所示。从反应开始到平衡,甲醇的平均反应速率v(CH3OH)=;氢气的转化率为。
(2)常温常压下已知下列反应的能量变化如Ⅱ图所示:写出由二氧化碳和氢气制备甲醇的热化学方程式:,该反应的△S___0(填“>”或“<”或“=”);反应达到平衡后,要使该平衡向右移动,其它条件不变时,可以采取的措施有(填序号)。
| A.缩小反应器体积 | B.升高温度 |
| C.恒容条件下通入CO2 | D.使用合适的催化剂 |
(3)在实际生产中发现,随着甲醇的生成,还伴随有少量CO等副产物出现,且CO2的转化率、甲醇和CO的含量还受气体混合物在反应锅炉内的流动速率、催化剂CuO的质量分数影响。通过实验分别得到如下图。
①由图Ⅲ得,生产甲醇的气体最佳流动速率为L•h-1;
②已知当催化剂中没有CuO,只有单组份ZnO时,反应速率最大。说明为什么不选择单组份ZnO的原因,根据图Ⅳ判断,催化剂CuO的质量分数最好为%。